
| A. | ①④ | B. | ④⑥ | C. | ②⑤ | D. | ②③ |
分析 ①无色溶液中不含有色离子,离子之间不反应的能大量共存;
②pH=11的溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存;
③水电离出的c(H+)=l0-12mol.L-1的溶液呈酸性或碱性;
④加入A1放出H2的溶液为非氧化性酸溶液或碱溶液;
⑤无色溶液不含有色离子;
⑥酸性溶液中含有大量氢离子,酸性条件下硝酸根离子和碘离子发生氧化还原反应.
解答 解:①无色溶液中不含有色离子,离子之间不反应的能大量共存,HCO3-、A13+发生双水解反应而不能大量共存,故错误;
②pH=11的溶液呈碱性,离子之间不反应且和氢氧根离子不反应的能大量共存,这几种离子之间不反应且,所以能大量共存,故正确;
③水电离出的c(H+)=l0-12mol.L-1的溶液呈酸性或碱性,酸性条件下不能大量存在HCO3-、S2-,碱性条件下不能大量存在NH4+、HCO3-,故错误;
④加入A1放出H2的溶液为非氧化性酸溶液或碱溶液,硝酸和Al反应生成氮氧化物而不是氢气,碱性条件下不能大量存在Cu2+、NH4+,故错误;
⑤无色溶液不含有色离子,这几种离子之间不反应且无色,所以能大量共存,故正确;
⑥酸性溶液中含有大量氢离子,酸性条件下硝酸根离子和碘离子发生氧化还原反应而不能大量共存,故错误;
故选C.
点评 本题考查离子共存,为高频考点,明确离子性质及离子共存条件是解本题关键,涉及复分解反应、双水解反应及氧化还原反应,注意题干中限制性条件,为易错题.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:解答题
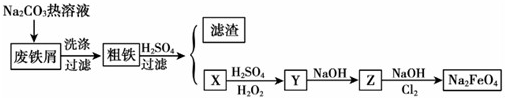
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
如表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把没用完的药品倒回原试剂瓶中保存 | |
| B. | 配制稀硫酸时,先在量筒内放好水,再缓缓地加入一定量的浓硫酸 | |
| C. | 用天平称量药品质量时,先加质量大的砝码,再加质量小的砝码 | |
| D. | 用排水取气法收集气体时,导管应插入试管底部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素非金属性按X、Y、Z的顺序减弱 | |
| B. | 单质的氧化性按X、Y、Z的顺序增强 | |
| C. | 简单阴离子的还原性按X、Y、Z的顺序减弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 这种饮料不含任何化学物质 | |
| B. | 长期饮用纯水,对身体有益 | |
| C. | 这种“神奇液体”加入水中,可以“以水代油”作为发动机的燃料 | |
| D. | 没有水就没有生命 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH.
.固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有沉淀产生的,写出该反应的离子方程式为:Na2O2+Na2S+2H2O=S+4NaOH. 2SO3(g)△H=-197KJ/mol.
2SO3(g)△H=-197KJ/mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | |
| B. | 20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com