
下列的叙述中不正确的是
[ ]
A.卤化氢分子中,卤素的非金属越强,共价键的极性越强,稳定性也强,而分子间作用力越小
B.分子作用力越大的,它的化学性质越稳定
C.判断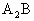 或
或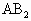 型分子是否是极性分子的依据是:具有极性键且分子构型不对称、键角小于
型分子是否是极性分子的依据是:具有极性键且分子构型不对称、键角小于 的非直线型结构
的非直线型结构
D.非极性分子中,各原子间都应以非极性键结合
|
对比HF、HCl、HBr、HI分子中H-X极性键强弱,卤素中非金属性越强的键长短、极性键强是对的,而分子间作用力对同一类型的分子来说,质量大的作用力就强,也是对的. 化学性质的稳定性取决于化学键的键能与分子间作用力无关.
都以非极性键结合的双原子分子自然是非极性分子,对多原子分子来讲,可以是极性键构成但构型对称,即分子中正电荷负电荷的重心完全重合,也可以构成非极性分子. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、氯气是一种黄绿色,有刺激性气味的气体 | B、将钠保存在水中 | C、氯气能溶于水 | D、将一小块钠放在石棉网上加热,观察现象察现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、上述钛原子中,中子数不可能为22 | B、钛元素在周期表中处于第四周期 | C、钛的各种同位素在周期表中处于不同的位置 | D、钛的各种同位素化学性质几乎相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该温度下加入等体积pH=12的NaOH溶液可使该溶液恰好呈中性 | B、由水电离出来的H+的浓度是1.0×10-10mol/L | C、加入NaHSO4晶体抑制了水的电离 | D、该温度高于25℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com