
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:_______________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施):_______________________。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为__________________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为____________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=______(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入_____(填序号)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
【答案】 2N2H4(g)+N2O4(g)===3N2(g)+4H2O(g) ΔH=-1 096.7 kJ·mol-1 高压、低温(或加压、降温) 正极 CH4-8e-+4O2-===CO2+2H2O 4OH--4e-===2H2O+O2↑ 1 ac
【解析】(1)本题考查热化学反应方程式的计算,①N2H4与N2O4反应的方程式为:2N2H4+N2O4=3N2+4H2O,①N2(g)+2O2(g)=N2O4(g),②N2H4(g)+O2(g)=N2(g)+2H2O(g)②×2-①得出:N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH=[2×(-543)-10.7]kJ·mol-1=-1 096.7 kJ·mol-1;②N2O4![]() 2NO2,促使平衡向逆反应方向进行,可以增大压强,此反应属于吸热反应,也可以降低温度;(2)①考查原电池的工作原理和电极反应式的书写,根据电流的方向,电流从正极流向负极,即c为正极,d为负极,通入的B为CH4,电解质传导O2-,因此负极电极反应式为:CH4+4O2--8e-=CO2+2H2O;②考查电解原理以及关于电解的计算,a连接电源的正极,a为阳极,a电极反应式为4OH--4e-=2H2O+O2↑;电解CuSO4溶液总反应方程式为2Cu2++2H2O
2NO2,促使平衡向逆反应方向进行,可以增大压强,此反应属于吸热反应,也可以降低温度;(2)①考查原电池的工作原理和电极反应式的书写,根据电流的方向,电流从正极流向负极,即c为正极,d为负极,通入的B为CH4,电解质传导O2-,因此负极电极反应式为:CH4+4O2--8e-=CO2+2H2O;②考查电解原理以及关于电解的计算,a连接电源的正极,a为阳极,a电极反应式为4OH--4e-=2H2O+O2↑;电解CuSO4溶液总反应方程式为2Cu2++2H2O![]() 2Cu+O2↑+4H+,假设Cu2+全部被电解成Cu,此时产生氧气的物质的量为100×10-3×0.5/2mol=0.025mol,体积为0.025×22.4L= 0.56L>56mL,因此Cu2+没有完全电解,因此有n(H+)=56×10-3×4/22.4mol=0.01mol,c(H+)=0.01/100×10-3mol·L-1=0.1mol·L-1,则pH=1; 根据上述分析,只电解部分Cu2+,因此恢复到电解前的在状态,应加入CuO或CuCO3,即ac正确。
2Cu+O2↑+4H+,假设Cu2+全部被电解成Cu,此时产生氧气的物质的量为100×10-3×0.5/2mol=0.025mol,体积为0.025×22.4L= 0.56L>56mL,因此Cu2+没有完全电解,因此有n(H+)=56×10-3×4/22.4mol=0.01mol,c(H+)=0.01/100×10-3mol·L-1=0.1mol·L-1,则pH=1; 根据上述分析,只电解部分Cu2+,因此恢复到电解前的在状态,应加入CuO或CuCO3,即ac正确。


 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】关于CaF2的表述正确的是( )
A.构成的微粒间仅存在静电吸引作用B.熔点低于CaCl2
C.与CaC2所含化学键完全相同D.在熔融状态下能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a—淀粉酶的最适温度为60℃,某同学为了探究pH对a—淀粉酶活性的影响,在35℃和45℃两个温度条件下分别设置了7支试管,每支试管中均加入4 mL淀粉溶液(淀粉的初始含量为yo g),然后加入pH缓冲液,设置pH值分别为1.0、3.0、5.0、7.0、9.0、11.0、13.0,再加入2 mL a—淀粉酶溶液,反应3 min盾迅速在每支试管中同时加入足量的NaOH溶液,测定每支试管中的淀粉的剩余量,得到如图所示的曲线。请回答下列问题:
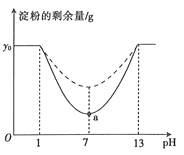
(1)反应3 min后迅速加入足量的NaOH溶液的目的是 。该同学认为反应时间过长或加入的淀粉量少都可能导致实验失败,其依据是酶的催化具有____的特点。
(2)分析图中数据可知,实线部分表示在温度为 条件下测定的结果;使a—淀粉酶完全失活的pH范围为 ;图中a点限制酶促反应速率的外界因素主要是____。
(3)若该同学在某pH条件下测定淀粉的剩余量为y1 g,则用淀粉的消耗速率表示该条件下促反应速率为 g/min。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的3个图分别为探索温度、反应物浓度、pH对淀粉酶催化作用的实验结果图示。

(1)酶与无机催化剂相比,__________________________,因而催化效率更高。
(2)图甲体现了酶的_________________的特性
(3)探索温度对酶活性影响最合理的实验步骤是 。
①取3支试管,编号并分别注入2 mL淀粉溶液
②向各试管注入1 mL淀粉酶溶液
③向各试管滴一滴碘液
④将3支试管分别放在60℃的热水、沸水和冰块中保持5 min
⑤观察实验现象
A.①②④③⑤ B.①③②④⑤ C.①③④②⑤ D.①④②③⑤
(4)图乙中,反应物达到某一浓度时,反应速率不再上升,原因是 。
若检验本实验的生成物,应选用的试剂是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解读与酶有关的曲线:回答下列问题:


(1)酶的作用机理可以用甲图中 线段来表示。如果将酶催化改为无机催化剂催化该反应,则b在纵轴上将________(上移/下移)。
(2)若该酶是胃蛋白酶,其作用的底物是 。若胃蛋白酶浓度和其他条件不变,反应液pH值由10逐渐降低到2,则酶催化反应的速度将___________。
(3)底物一定量时,乙图中160min时,生成物的量不再增加的原因是
(4)联系所学内容,分析丙图曲线,并回答:
①对于曲线abc:若X轴表示PH,则曲线上b点表示的生物学意义是_________。
②对于曲线abd:若X轴表示反应物浓度,则Y轴可表示 。制约曲线bd增加的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 良好的生态环境可以提升生活质量。
① 下列物质不属于空气质量周报中污染物的是________(填字母)。
a. SO2 b. NO2 c. PM2.5
② 垃圾应分类收集。导致“白色污染”的生活垃圾应放置于贴有________(填字母)标志的垃圾桶内。

③ 燃烧煤产生的SO2所形成的酸雨中,SO2最终转化成的酸是________(填化学式)。
(2) 右图是某品牌调料标签的一部分。

① 配料中的大量氨基酸态氮来源于黄豆中的蛋白质发生________反应得到。
② 小麦粉中的主要营养物质是________。
③ 配料表中属于防腐剂的是________。
④ 配料表中的辣椒红是着色剂。亚硝酸钠也可作着色剂,但亚硝酸钠有毒,要严格控制其用量。亚硝酸钠外观和咸味与食盐很相似,因此要防止因误食亚硝酸钠而发生事故。亚硝酸钠和氯化钠的部分性质如下表:
性质 | 亚硝酸钠 | 氯化钠 |
1. 酸性条件下的稳定性 | 微热分解为NO和NO2 | 微热时不分解 |
2. 熔点 | 271 ℃ | 801 ℃ |
3. 室温时的溶解度 | 约80 g | 约35 g |
请根据表中信息设计一种鉴别NaNO2和NaCl的方法,写出简单的操作过程、现象和结论:________。
(3) 材料是人类赖以生存和发展的重要物质基础。
① 钢铁是应用广泛的金属材料。钢铁在潮湿空气中易生锈,铁锈的主要成分是____________(填化学式),请列举一种防止钢铁腐蚀的方法:________。
② 水泥、玻璃、陶瓷是生活中常见的硅酸盐材料。制备普通玻璃的原料有CaCO3、________和________(填化学式)。青瓷是中国最早发明的瓷器,青瓷表面的绿色是釉层中的________价铁元素显色而成的。
③ 氮化硅陶瓷抗腐蚀能力强,工业上可用四氯化硅和氮气在氢气气氛中加强热发生反应制得。请写出该反应的化学方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加水溶解,所加的水量应为: (填选项)
A.多加水配成较稀的溶液
B.加入适量的水至能溶解的固体溶解即止
(2)将(1)中配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:(填选项)
A.①②③B.②⑥⑤C.④⑥①D.①④⑥E.⑥①④F.⑥②⑤
将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用:
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、和
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L的偏差是:(填“偏大”、“偏小”、“无影响”)
①在上述(2)步中没有使用盐酸处理滤液,结果会
②没有对烧杯和玻璃棒进行洗涤,结果会
③定容时俯视凹液面,结果会
④上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,结果会 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com