
分析 (1)要使硝酸根离子发生还原反应,则需要加入还原剂,根据给予物质的性质判断;
(2)根据NO和转移电子之间的关系式计算;
(3)被还原硝酸的物质的量增加,说明每摩尔硝酸根离子得电子数减少.
解答 解:(1)要使硝酸根离子发生还原反应,则需要加入还原剂,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中KMnO4、Fe2(SO4)3具有强氧化性,Na2CO3没有氧化性和还原性,Cu2O有还原性,所以能使硝酸根离子发生还原反应的是Cu2O,二者反应生成硝酸铜、NO和水,反应方程式为14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O,
故答案为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O;
(2)反应中若产生0.2mol气体,则转移电子的数=0.2mol×(5-2)mol=0.6mol,故答案为:0.6;
(3)被还原硝酸的物质的量增加,说明每摩尔硝酸根离子得电子数减少,则生成的气体是二氧化氮,故答案为:使用了较浓的硝酸,产物中有部分二氧化氮生成.
点评 本题考查氧化还原反应,为高考常见题型,注意把握元素的化合价及反应中的变化为解答的关键,侧重基本概念和转移电子数的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 阳离子只有氧化性,阴离子只有还原性 | |
| B. | 阴极发生还原反应,正极亦发生还原反应 | |
| C. | Cl2与碱溶液的反应,实质是HClO与OH-的反应 | |
| D. | 从氯水中分离出HClO,可加入CaCO3蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y2为0.15mol/L | B. | Z为0.2mol/L | C. | X2为0.3mol/L | D. | Z为0.4mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
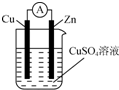 将锌棒和铜棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )
将锌棒和铜棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是( )| A. | 该装置是将电能转化为化学能 | |
| B. | 锌棒为正极 | |
| C. | 电子由铜棒流出 | |
| D. | 该电池总反应为Zn+CuSO4═ZnSO4+Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CDEBA | B. | ECDAB | C. | BAEDC | D. | CDBAE |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液呈浅绿色 | |
| B. | 该溶液中加入NaOH溶液,生成白色沉淀并迅速变成灰绿色,最终变为红褐色 | |
| C. | 向该溶液中加入氯水,再滴入几滴KSCN溶液,呈红色 | |
| D. | 向该溶液中滴入几滴KSCN溶液,不变色,再加入氯水,有红色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | 不含Li、Na等活泼金属 |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体产生,溶液呈无色 | 可能含铍(Be)、镁(Mg)、铝(Al)三种金属中的任意两种 |
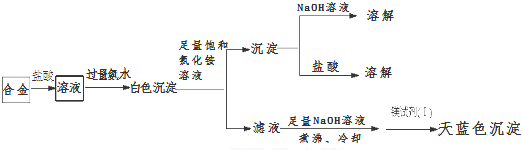

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8 g Na2O2与足量水反应转移的电子数为0.2NA | |
| B. | 常温常压下,1 mol CH4中含有的氢原子数为4NA | |
| C. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| D. | 12.0 g熔融的NaHSO4中含有0.1NA个Na+、0.1NA个H+和0.1NA个SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期/族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | ○ |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com