
| A. | Al2O3 | B. | Fe2O3 | C. | Al(OH)3 | D. | Fe(OH)3 |
分析 Al、Al2O3、Al(OH)3、弱酸酸式盐、弱酸的铵盐、氨基酸和蛋白质都既能和稀盐酸反应又能和NaOH反应,由两种元素组成且其中一种元素是O元素的化合物是氧化物,据此分析解答.
解答 解:A.氧化铝能和稀盐酸、NaOH溶液反应生成盐和水,所以属于两性氧化物,故A正确;
B.氧化铁能和盐酸溶液反应生成盐和水,但不能和氢氧化钠反应,属于碱性氧化物,故B错误;
C.氢氧化铝能和稀盐酸、氢氧化钠溶液反应生成盐和水,属于两性氢氧化物,故C错误;
D.氢氧化铁不能与氢氧化钠反应,只能与盐酸反应,而且不是氧化物,故D错误;
故选A.
点评 本题考查元素化合物性质及基本概念,明确物质性质及概念内涵是解本题关键,注意物质性质的总结归纳,题目难度不大.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:解答题
 Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.
Ⅰ.(1)某学习小组用0.80mol/L标准浓度的氢氧化钠溶液测定未知浓度的盐酸.| 实验编号 | 待测盐酸溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 23.00 |
| 2 | 20.00 | 23.10 |
| 3 | 20.00 | 22.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
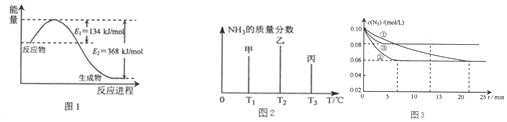
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉跟稀硫酸反应Fe+2H+=Fe2++H2↑ | |
| B. | 氧化铝和稀硫酸反应 O2-+2H+=H2O | |
| C. | 氢氧化钡溶液跟稀硫酸反应 Ba2++SO42-=BaSO4↓ | |
| D. | 铜与硝酸银溶液反应:Cu+Ag+═Ag+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电性好 | B. | 不易生锈 | C. | 光泽度好 | D. | 强度高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用物质的量表示分子、原子、离子、米粒等微粒或小颗粒物质 | |
| B. | 摩尔是国际单位制中的七个基本物理量之一 | |
| C. | 1mol任何物质都含有 6.02×1023个原子 | |
| D. | 0.012Kg12C所含碳原子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳-非电解质 氯化银-强电解质 碳酸-弱电解质 | |
| B. | NO2-酸性氧化物 CuO-碱性氧化物 Al2O3-两性氧化物 | |
| C. | 冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 | |
| D. | 碘酒、淀粉溶液、水雾、纳米材料均为胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
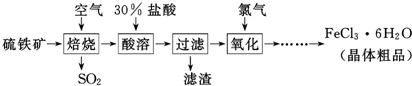

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com