
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 5 。
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为________________________________________________________________________
________________________________________________________________________。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)===N2O4(l) ΔH1=-195kJ·mol-1
②N2H4(l)+O2(g)===N2(g)+2H2O(g) ΔH2=-534.2kJ·mol-1
写出肼和N2O4反应的热化学方程式________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(4)肼—空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为________________________________________________________________________
________________________________________________________________________。
(1)5 (2)2NH3+NaClO===N2H4+NaCl+H2O
(3)2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH=-1048.9kJ·mol-1 (4)N2H4-4e-+4OH-===N2+4H2O
解析:(1)N原子的原子结构示意图为: ,故其L层上有5个电子;
,故其L层上有5个电子;
(2)NH3+NaClO——N2H4,根据元素守恒还应生成NaCl和H2O,观察法可配平方程式为 2NH3+NaClO===N2H4+NaCl+H2O;
(3)肼与N2O4反应生成N2和水蒸气:2N2H4+N2O4===3N2+4H2O,观察已知的两个热化学方程式可知,②×2-①得:2N2H4(l)+N2O4(l)===3N2(g)+4H2O(g) ΔH=ΔH2×2-ΔH1=-1048.9kJ·mol-1;
(4)肼—空气燃料电池是一种碱性电池,O2在正极反应,故负极是肼发生反应:N2H4-4e-+4OH-===N2+4H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 ▲ 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg ▲ Al | O ▲ S | MgO ▲ MgS | H2O ▲ H2S |
(3)基态铬原子外围电子轨道表示式为 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.硅和石墨都是重要的半导体材料
B.SO2、NO2、CO2都会导致酸雨的形成
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理不同
D.氢能是清洁能源,工业上用电解水法制大量氢气符合节能减排理念
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A.肯定有SO2和NO B.可能有Cl2、O2和NO2
C.可能有Cl2和O2 D.肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法不正确的是( )
A.洗气瓶中产生的沉淀是碳酸钡
B.在Z导管出来的气体中有二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡
D.在Z导管口有红棕色气体出现
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:等质量的X、Y、Z粉末分别与足量的溶质质量分数相同的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况用下图来表示。下列顺序正确的是( )
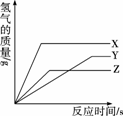
A.金属活动性由强到弱:X>Z>Y
B.金属活动性由强到弱:X>Y>Z
C.相对原子质量由大到小:X>Z>Y
D.相对原子质量由大到小:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
在Al2(SO4)3、K2SO4和明矾的混合溶液中,如果c(SO )等于0.2 mol/L,当加入等体积的0.2 mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混合物中K+的物质的量浓度为( )
)等于0.2 mol/L,当加入等体积的0.2 mol/L的KOH溶液时,生成的沉淀恰好溶解,则原混合物中K+的物质的量浓度为( )
A.0.2 mol/L B.0.25 mol/L
C.0.45 mol/L D.0.225 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关铝或其化合物的说法中不正确的是( )
A.制备AlCl3不能采用将溶液直接蒸干的方法
B.工业上采用电解AlCl3的方法冶炼金属铝
C.实验室常用氨水和硫酸铝溶液制备Al(OH)3
D.存在于污水中的胶体物质,常用投加明矾等电解质的方法进行处理
查看答案和解析>>
科目:高中化学 来源: 题型:
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱顺序为
Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是( )
A.H2O2+H2SO4===SO2↑+O2↑+2H2O
B.2Fe3++SO2+2H2O===2Fe2++SO +4H+
+4H+
C.SO2+I2+2H2O===H2SO4+2HI
D.2Fe2++Cl2===2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com