
1000K时,反应C(s)+2H2(g)  CH4(g)的 K=8.28×107,当各气体物质的量浓度分别为H2 0.7 mol·L-1、CH4 0.2 mol·L-1时,上述平衡
CH4(g)的 K=8.28×107,当各气体物质的量浓度分别为H2 0.7 mol·L-1、CH4 0.2 mol·L-1时,上述平衡
A.向正反应方向移动 B.向逆反应方向移动
C.达到平衡 D.无法判断移动方向
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2015-2016学年湖北省襄阳市高一5月月考化学试卷(解析版) 题型:选择题
在一定条件下的密闭容器中,一定能说明可逆反应N2(g)+3H2(g) 2NH3(g)达到平衡状态的是( )
2NH3(g)达到平衡状态的是( )
A.混合气体的密度不再发生变化
B.反应速率之比υ(N2):υ(H2):υ(NH3)=1:3:2
C.每生成3molH2的同时消耗2molNH3
D.每断裂1molN≡N键的同时断裂6molN-H键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省徐州市高二下第二次质量检测化学试卷(解析版) 题型:填空题
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn; ③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:(填写时用对应元素符号或物质的化学式)
(1)五种元素原子中基态时未成对电子数最多的是 。
(2)基态原子Y的轨道表示式是: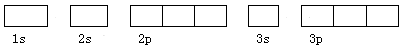
(3)基态原子Z 的电子排布式是 。向Z的硫酸盐溶液中加入过量氨水时反应的离子方程式是 ,所得产物中含Z元素在内的离子的结构示意图是:(不考虑空间构型,如有配位键,请标出)
(4)Q、R、X的电负性由小到大的顺序是 。
(5)Q、X和Y的氢化物稳定性由小到大的顺序为 。
(6)在一定条件下,原子的核外电子从激发态跃迁到基态产生的光谱属于 光谱(填“吸收”或“发射”),该光谱可用于 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省江阴市高二下期中化学试卷(解析版) 题型:填空题
锌及其化合物用途广泛。火法炼锌以闪锌矿(主要成分是ZnS)为主要原料涉及的主要反应有: 2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g)  H1=-930 kJ·mol-1
H1=-930 kJ·mol-1
2C(s) + O2(g) = 2CO(g)  H2=-221 kJ·mol-1
H2=-221 kJ·mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g)  H3= +198 kJ·mol-1
H3= +198 kJ·mol-1
(1)反应ZnS(s) + C(s) + 2O2(g) = Zn(g) + CO2(g) + SO2(g)的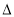 H4= kJ·mol-1。
H4= kJ·mol-1。
反应中生成的CO2与NH3混合,在一定条件下反应合成尿素:
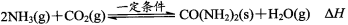
若该反应在一恒温、恒容密闭容器内进行,判断反应达到平衡状态的标志是 。
a.CO2与H2O(g)浓度相等 b.容器中气体的压强不再改变
c.2v(NH3)正 = v(H2O)逆 d.容器中混合气体的密度不再改变
(2)硫酸锌可广泛用作印染媒染剂和木材防腐剂。 ZnSO4受热分解过程中各物质物质的量随温度变化关系如图所示。
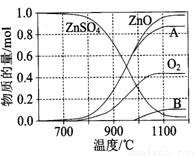
①写出700℃~980℃时发生反应的化学方程式: ,物质B的化学式是 。
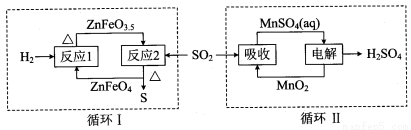
②硫酸锌分解生成的SO2经下图中的两个循环可分别得到S和H2SO4。写出循环I中反应2的化学方程式: ;循环II中电解过程阳极反应式是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省江阴市高二下期中化学试卷(解析版) 题型:选择题
下列关于反应过程中能量变化的说法正确的是
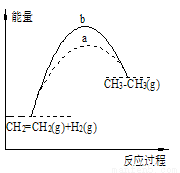
A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化
B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省江阴市高二下期中化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3—、SO42—、Na+
B.C(H+)/C(OH—)=1012的溶液中:NH4+、Al3+、NO3—、Cl—
C.由水电离的C(H+)=10—14mol.L—1的溶液中:Ca2+、K+、Cl—、HCO3—
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆石河子二中高一下学期第二次月考化学试卷(解析版) 题型:填空题
下面列出了几组物质,请将物质的合适组号填写在空格上。
① 金刚石与石墨; ② 氧气(O2)与臭氧(O3);
③ 16O、17O和18O; ④ CH4和CH3CH2CH3;
⑤ 乙烯和乙烷;
⑥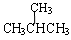 和
和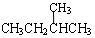 ; ⑦
; ⑦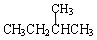 和
和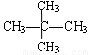 ;
;
(1)同位素 ,(2)同素异形体 ,
(3)同系物 ,(4)同分异构体 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆石河子二中高一下学期第二次月考化学试卷(解析版) 题型:选择题
合成氨的反应进行到2秒时,氨气的浓度增加了0.6mol/L.用氮气的浓度变化表示该时间段的反应速率为( )
A.0.15 mol/(L•s) B.0.3 mol/(L•s)
C.0.6 mol/(L•s) D.0.9 mol/(L•s)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津市静海县六校高一下学期期中联考化学试卷(解析版) 题型:填空题
现有A、B、C、D、E、F、G七种元素,其中 A、B、C、D、E、F为短周期元素且原子序数依次增大;A的最高正价与最低负代数和为零;B的最高价氧化物与C的氢化物在水中反应得到的生成物X既可与酸反应又可与碱反应;常温下D2是气体,标况时D2气体的密度约是1.43g/L;E原子半径在同周期中除稀有气体外最大, F原子M层上的电子比K层多5个。金属G的合金在生活中用量最大,用途最广。
(1)G在元素周期表中的位置是_________,画出F的离子结构示意图____________
(2)D、E、F离子半径由大到小顺序为:___________________(用离子符号表示)
(3)A与D可形成原子个数比为1:1的化合物,用电子式表示该化合物的形成过程_________________________
(4)D与E形成某离子化合物H具有漂白性,写出H的电子式_______________,该化合物和B与D形成的某化合物反应的化学方程式为:_______________,1molH发生该反应转移电子数为_____________
(5)若X为正盐,X中含有的化学键类型为_______________,写出加热该盐的化学方程式:_______________
(6)B和F两种元素相比较,原子得电子能力较强的为_______________,以下三种说法中,可以验证B和F得电子能力强弱的是_______________(填写编号);
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,F元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(7)金属元素G可与F形成化合物GF3。将G的单质与石墨用导线相连浸入GF3溶液中形成一个原电池。该原电池工作时,石墨一极发生的反应可以表示为___________,当有1.2mol e-转移时单质G质量变化为___________g
(8)用A元素的单质与D元素的常见单质可以制成电池,电池中装有KOH浓溶液,用多孔的惰性电极甲和乙浸入KOH溶液,在甲极通入A的单质,乙极通入D的单质,则甲极的电极反应式为:___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com