
| A. | 0.288g | B. | 0.366g | C. | 0.384g | D. | 0.396g |
分析 经分析知,高锰酸钾溶液的物质的量n=CV=0.0054mol,其中一部分和CuS和Cu2S组成的混合物反应,一部分和15mL0.2mol•L-1硫酸亚铁溶液中的Fe2+反应,根据消耗的Fe2+的物质的量n=CV=0.003mol,可知被反应掉的高锰酸钾的物质的量,从而可知被CuS和Cu2S消耗掉的高锰酸钾的物质的量,再根据若混合物中只有CuS和Cu2S只有来讨论.
解答 解:经分析知,高锰酸钾溶液的物质的量n=CV=0.0054mol,其中一部分和CuS和Cu2S组成的混合物反应,其余的和15mL0.2mol•L-1硫酸亚铁溶液中的Fe2+反应.
被由于消耗的Fe2+的物质的量n=CV=0.003mol,设被Fe2+消耗的高锰酸钾的物质的量为xmol,根据和高锰酸钾溶液的反应关系可知:
5Fe2+~MnO4-
5 1
0.003mol xmol
故有:$\frac{5}{0.003mol}$=$\frac{1}{xmol}$ 解得X=0.0006mol
可知被CuS和Cu2S组成的混合物反应掉的高锰酸钾的物质的量n=0.0054mol-0.0006mol=0.0048mol.
(1)若固体中只有CuS.设CuS的物质的量为ymol,根据其与高锰酸钾溶液的反应可知:
5CuS~8MnO4-
5 8
ymol 0.0048mol
故有:$\frac{5}{ymol}=\frac{8}{0.0048mol}$
解得y=0.003mol,则质量m=0.288g;
(2)若固体中只有Cu2S.设Cu2S的物质的量为zmol,根据其与高锰酸钾溶液的反应可知:
Cu2S~2MnO4-
1 2
zmol 0.0048mol
故有:$\frac{1}{zmol}=\frac{2}{0.0048mol}$
解得z=0.003mol,则质量m=0.384g;
综合分析可知,CuS和Cu2S的混合物的质量介于0.288g到0.384g之间,故选B.
点评 本题考查了氧化还原反应的有关计算,难度较大,应注意根据混合物的组成来分类讨论,注意解题思路的梳理.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | O2->F->Na+>Mg2+ | B. | Na>Mg>Cl>Ar | C. | I>Br>F>Cl | D. | Na>Na+>S2->S |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
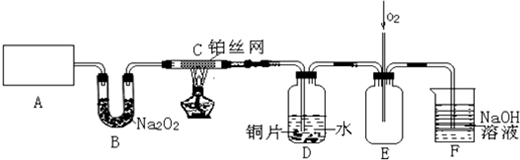
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Po-218和Po-210在元素周期表中的位置相同 | |
| B. | Po-218和Po-210中子数相同,互称为同位素 | |
| C. | Po-218和Po-210核外电子数肯定不相等 | |
| D. | Po-218和Po-210的质量数不同,不能互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮元素可形成卤化物、叠氮化物及络合物等.
氮元素可形成卤化物、叠氮化物及络合物等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉在水里形成的透明液体 | |
| B. | 氧化钴(Co2O2)分散在普通玻璃里形成蓝色有机玻璃 | |
| C. | 饱和FeCl3溶液滴入沸水中所形成的红褐色液体 | |
| D. | 将0.1g蔗糖加到10mL蒸馏水中,振荡后形成的无色液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com