
【题目】下列描述正确的是( )
A. ClO3-的空间构型为平面三角形B. SF6中有6对相同的成键电子对
C. 含π键的物质不如只含σ键的物质稳定D. SiF4和SO32-的中心原子均为sp2杂化
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3L的密闭容器中化学反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡状态。
CH3OH(g)达到平衡状态。
(1)该反应的平衡常数表达式K=______;根据图,升高温度,K值将______(填“增大”“减小”或“不变”)。

(2)500℃时,从反应开始达到化学平衡,以H2的浓度变化表示的化学反应速率是______(用nB、tB表示)。
(3)判断该可逆反应达到化学平衡状态的标志是_________(填字母,下同)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度之比为1:2:1
(4)300℃时,将容器的容积压缩到原来的![]() ,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是______(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式:
(i)I2(g)+H2(g) ![]() 2HI(g)+9.48kJ (ii)I2(s)+H2(g)
2HI(g)+9.48kJ (ii)I2(s)+H2(g)![]() 2HI(g)-26.48kJ
2HI(g)-26.48kJ
下列判断正确的是( )
A.![]() 中通入
中通入![]() ,反应放热
,反应放热![]()
B.![]() 固态碘与
固态碘与![]() 气态碘所含的能量相差
气态碘所含的能量相差![]()
C.反应(i)的产物比反应(ii)的产物稳定
D.反应(ii)的反应物总能量比反应(i)的反应物总能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列营养物质在人体内发生的变化及其对人的生命活动所起的作用叙述中,不正确的是( )
A. 纤维素![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
B. 淀粉![]() 葡萄糖
葡萄糖 ![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
C. 蛋白质![]() 氨基酸
氨基酸![]() 人体所需的蛋白质(人体生长发育)
人体所需的蛋白质(人体生长发育)
D. 油脂![]() 甘油和高级脂肪酸
甘油和高级脂肪酸![]() CO2和H2O(释放能量维持生命活动)
CO2和H2O(释放能量维持生命活动)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法。答:____________________________。
(2)下列操作会使配制的KOH溶液的物质的量浓度偏大的是_______
A、转移溶液后未洗涤烧杯和玻璃棒就直接定容
B、转移溶液过程中有液体溅出容量瓶
C、定容时俯视刻度线
D、配制溶液定容摇匀后发现容量瓶中液面低于刻度线,又补足了水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4气体分子。N4分子结构如图所示,下列说法正确的是( )
![]()
A. N4分子的键角为109°28′B. N4的沸点比N2低
C. 1 mol N4分子所含共价键数为4NAD. N4分子中只含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是某工厂的生产流程:
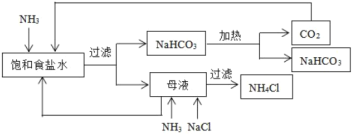
下列分析正确的是( )
A.母液中只含有:NH3和CO2B.母液中只含有:NH4+和Cl-
C.向母液中通NH3、加NaCl时加热D.该工厂的产品是纯碱和NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线的强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态价电子排布式可表示为_____。
(2)MX3-的空间构型是_________;H2X分子的空间构型为__________。
(3)从核外电子排布角度解释高温下Z2O比ZO更稳定的原因_________。
(4)AlP因杀虫效率高、廉价易得而被广泛应用。已知AlP的熔点为2000℃,其晶胞结构如图所示。
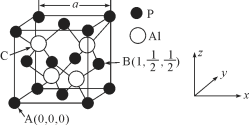
①磷化铝的晶体类型为_____。
②A、B点的原子坐标如图所示,则C点的原子坐标为____。
③磷化铝的晶胞参数a=546.35pm(1pm=10-12m),其密度为_____g/cm3(列出计算式即可,用NA表示阿伏加德罗常数的数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、碳、镓、砷、硒的化合物被广泛应用于新材料制备、生活生产等诸多领域。根据物质结构相关知识,回答下列问题:
(1)第四周期镓、砷、硒三种元素中,第一电离能由大到小顺序为___,电负性由大到小顺序为___(用元素符号填写)
(2)元素氮与砷同族。基态氮元素的价电子排布式为___,预测砷的氢化物分子的立体结构为___,其沸点比NH3的___(填“高”或“低”),其判断理由是___。
(3)硼及化合物应用广泛。已知BP的熔点很高,其晶胞结构如图所示。
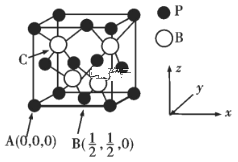
C点的原子坐标为___,B原子与P原子的最近距离为dpm,晶体的密度为pg/cm3,NA代表阿伏加德罗常数的值,则ρ=___g/cm3(用含d、NA的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com