
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
分析 A.为可逆反应;
B.发生缩聚反应;
C.分子式为C5H12O的有机物,它的同分异构体中,经氧化可生成醛,该有机物属于醛,且连接羟基的碳原子上含有2个氢原子,确定C5H12的同分异构体,-OH取代C5H12中甲基上的H原子;
D.甲基具有甲烷的结构.
解答 解:A.酯化反应为可逆反应,反应物不可能全部转化为生成物,故A错误;
B.对苯二甲酸 与乙二醇发生缩聚反应,故B错误;
C.分子式为C5H12O的有机物,它的同分异构体中,经氧化可生成醛,该有机物属于醛,且连接羟基的碳原子上含有2个氢原子,确定C5H12的同分异构体,-OH取代C5H12中甲基上的H原子,
C5H12的同分异构体有:CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、(CH3)4C,
当烷烃为CH3CH2CH2CH2CH3,-OH取代甲基上的H原子有1种结构,
当烷烃为(CH3)2CHCH2CH3,-OH取代甲基上的H原子有2种结构,
当烷烃为(CH3)4C,-OH取代甲基上的H原子有1种结构,
C5H12O的同分异构体中可以氧化为醛的醇有4种;
故C正确;
D.甲基具有甲烷的结构,不可能在同一平面上,故D错误.
故选C.
点评 本题考查较为综合,涉及有机物的组成、结构、性质以及应用,为高考常见题型和高频考点,侧重于学生的分析能力的考查,有利于培养学生良好的科学素养,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硝酸银溶液与铁粉反应:2Ag++Fe═Fe2++2Ag | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
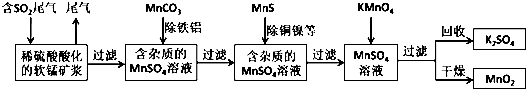
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 | |
| C. | 石油裂解、煤的干馏、玉米制醇、蛋白质的变性和纳米银粒子的聚集都是化学变化 | |
| D. | 燃料电池的燃料都在负极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀醋酸中加入少量冰醋酸能增大醋酸的电离程度 | |
| B. | 25℃时,等体积等浓度的盐酸与氨水混合后,溶液pH=7 | |
| C. | 0.1 mol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-) | |
| D. | 25℃时,0.1mol•L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所用HNO3为浓度为10mol/L | B. | NO的体积为6.72升 | ||
| C. | NO2的体积为3.36升 | D. | 被还原的HNO3为1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4+、NO3-、CO32-、Na+ | B. | Na+、A13+、H+、Cl- | ||
| C. | NO3-、NH4+、K+、Cl- | D. | NO3-、K+、AlO2-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水中有下列平衡Cl2+H2O═HCl+HClO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 氨水中加入NaOH固体有利于氨气的溢出 | |
| D. | pH=1的盐酸加水稀释到原体积的100倍后,PH=3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com