
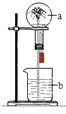
 在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )
在如图所示的装置中,烧瓶中充满干燥的气体a,将滴管内的液体b挤入烧瓶内,轻轻振荡烧瓶,并打开弹簧夹,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.则a和b分别可能是( )| A、NO2和水 |
| B、SO2和NaOH溶液 |
| C、NH3和稀盐酸 |
| D、Cl2和饱和NaCl溶液 |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取7.8mL浓H2SO4 |
| B、用碱式滴定管量取18.20mLKMnO4溶液 |
| C、酸碱中和滴定时,滴定管和锥形瓶需分别用标准液和待测液润洗 |
| D、读取标准液读数时,若滴定前仰视,滴定后俯视,会导致测定结果偏低 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )
如图所示,烧杯内装有蒸馏水,下部封有半透膜的长颈漏斗内装有淀粉和食盐溶液,漏斗颈内的液面略高于烧杯内蒸馏水的液面,过一段时间后用碘水和硝酸银溶液分别检验蒸馏水中的物质.整个实验过程中,所观察到的现象是( )| A、漏斗颈内液面下降 |
| B、漏斗颈内液面上升 |
| C、烧杯内液体遇硝酸银溶液没有白色沉淀生成 |
| D、烧杯内液体遇碘水变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:
现有氨水、醋酸、盐酸、氯化铵四种溶液,请回答下列问题:| C(NH3?H2O) |
| C(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、检验亚硫酸钠试样是否变质:试样
| ||||||||
B、从氧化铝、二氧化硅混合物中提取氧化铝:氧化铝(二氧化硅)
| ||||||||
C、除去氯化钠晶体中少量硝酸钾:试样
| ||||||||
D、从含有Ca2+、SO42-的粗盐中提取NaCl:粗盐水
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质名称 | 溶度积(Ksp) | pH | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)2 | 8.0×10-16 | 7.6 | 9.6 |
| Fe(OH)3 | 2.8×10-39 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 被提纯物质 | 除杂试剂(操作) | 分离方法 | |
| A | 溴乙烷(Br2) | Na2SO3溶液 | 分液 |
| B | NH4Cl(I2) | 加热 | 升华 |
| C | 乙烷(乙烯) | 酸性KmnO4溶液 | 洗气 |
| D | Al(OH)3胶体(N aCl固体) | 溶于水 | 抽滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com