
中华人民共和国国家标准(CB2760-2011)规定葡萄酒中SO2最大使用量为0.25 g·L-1。某兴趣小组用图(a)装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
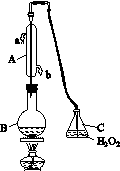
(a)
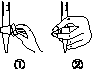
(b)
(1)仪器A的名称是__________________,水通入A的进口为________。
(2)B中加入300.00 mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中的H2O2完全反应,其化学方程式为________________________。
(3)除去C中过量的H2O2,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图(b)中的________;若滴定终点时溶液的pH=8.8,则选择的指示剂为________;若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积(填序号)________(①=10 mL,②=40 mL,③<10 mL,④>40 mL)。
(4)滴定至终点时,消耗NaOH溶液25.00 mL,该葡萄酒中SO2含量为________ g·L-1。
(5)该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:________________________________________________________________________
________________________________________________________________________。
[答案] (1)冷凝管或冷凝器 b (2)SO2+H2O2===H2SO4 (3)③ 酚酞 ④ (4)0.24
(5)原因:盐酸的挥发;改进措施:用不挥发的强酸(如硫酸)代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响
[解析] (1)根据仪器特点可知A是冷凝管,冷凝时冷却水的流向是下口进上口出,即进水口是b。(2)具有还原性的SO2遇具有氧化性的双氧水,发生氧化还原反应生成硫酸。(3)氢氧化钠是强碱,应用碱式滴定管量取,排液时的操作选择③;滴定终点的pH=8.8,应选择变色范围在8.2~10.0之间的酚酞;滴定管0刻度在上,且下端有一段没有刻度线,故体积大于40 mL。(4)依方程式可得关系式2NaOH~H2SO4~SO2,则SO2的质量是=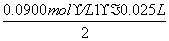 ×64 g/mol=0.072 g,则该葡萄酒中SO2的含量为0.072 g÷0.3 L=0.24 g/L。(5)由于盐酸是挥发性酸,进入C装置的SO2气体中混有HCl,消耗NaOH溶液的体积增加,使测量结果偏高;改进的措施可用难挥发的硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响。
×64 g/mol=0.072 g,则该葡萄酒中SO2的含量为0.072 g÷0.3 L=0.24 g/L。(5)由于盐酸是挥发性酸,进入C装置的SO2气体中混有HCl,消耗NaOH溶液的体积增加,使测量结果偏高;改进的措施可用难挥发的硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响。


科目:高中化学 来源: 题型:
一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对应关系正确的是( )
| A | CH3CH3+Cl2 CH2===CH2+HCl―→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br-===2Cl-+Br2 Zn+Cu2+===Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O===4NaOH+O2↑ Cl2+H2O===HCl+HClO | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫代硫酸钠是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
Ⅰ.【查阅资料】
(1)Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
(2)向Na2CO3和Na2S混合溶液中通入SO2可制得Na2S2O3,所得产品常含有少量Na2SO3和Na2SO4。
(3)Na2SO3易被氧化;BaSO3难溶于水,可溶于稀盐酸。
Ⅱ.【制备产品】
实验装置如图所示(省略夹持装置):
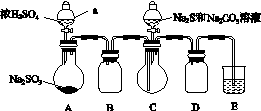
实验步骤:
(1)检查装置气密性,如图示加入试剂。
仪器a的名称是________;E中的试剂是________(选填下列字母编号)。
A.稀H2SO4
B.NaOH溶液
C.饱和NaHSO3溶液
(2)先向C中烧瓶加入Na2S和Na2CO3的混合溶液,再向A中烧瓶滴加浓H2SO4。
(3)待Na2S和Na2CO3完全消耗后,结束反应。过滤C中的混合物,滤液经________(填写操作名称)、结晶、过滤、洗涤、干燥、得到产品。
Ⅲ.【探究与反思】
(1)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____________________________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
(2)为减少装置C中生成Na2SO4的量,在不改变原有装置的基础上对实验步骤(2)进行了改进,改进后的操作是______________________________________________________________________________。
(3)Na2S2O3·5H2O的溶解度随温度升高显著增大,所得产品通过________方法提纯。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.锥形瓶可用作加热的反应器
B.室温下,不能将浓硫酸盛放在铁桶中
C.配制溶液定容时,俯视容量瓶刻度会使溶液浓度偏高
D.用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
a g Cu与含b g HNO3的溶液恰好反应,若a∶b=8∶21,则反应中被还原硝酸的质量为 ( )
A.b g B.b/2 g C.3b/4 g D.b/4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列4种装置工作一段时间后,测得导线上均通过了0.002mol 电子,此时溶液的pH值由大到小的排列顺序为(不考虑盐的水解和溶液体积变化)()
①盛100mL CuSO4 ②盛200mL 0.01mol•L﹣1 H2SO4 ③盛200mL ZnCl2 ④盛200mL NaCl饱和溶液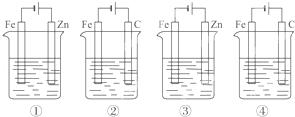
A. ④②③① B. ④③②① C. ④③①② D. ④①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.195 g锌粉加入到20.0 mL的0.100 mol·L-1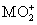 溶液中,恰好完全反应,则还原产物可能是( )
溶液中,恰好完全反应,则还原产物可能是( )
A.M B.M2+ C.M3+ D. MO2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com