
| 选项 | 目的 | 分离方法 | 原理 |
| A | 提取碘水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度比水中大 |
| B | 除去纯碱中的碳酸氢铵 | 加热 | 纯碱的热稳定性大于碳酸氢铵 |
| C | 分离KNO3和NaCl | 重结晶 | 硝酸钾的溶解度大于氯化钠 |
| D | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯密度大于乙醇 |
| A. | A | B. | B | C. | C | D. | D |
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO2 | B. | CaCO3+H2O+CO2═Ca(HCO3)2 | ||
| C. | CuO+2HCl═CuCl2+H2O | D. | NH4Cl $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量的氨气:NH4+、SO42-、Na+、AlO2- | |
| B. | 加入过量NaHCO3溶液:SO42-、Na+、Al3+、HCO3-、Fe2+ | |
| C. | 加入过量氯水:Cl-、SO42-、Fe3+、Al3+ | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:2:4:1 | B. | 1:1:1:1 | C. | 2:1:2:1 | D. | 1:2:1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
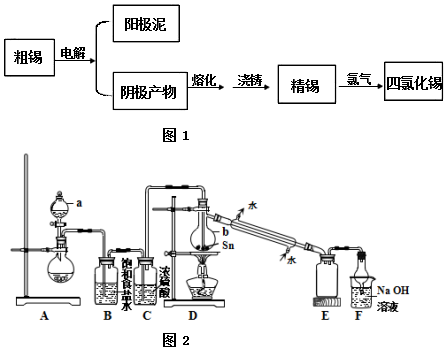
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
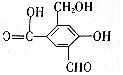 ,试回答下列问题:
,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、HCO3-、SO42-、Cl- | B. | Cu2+、NO3-、Cl-、SO42- | ||
| C. | H+、Cl-、K+、CO32- | D. | K+、Mg2+、SO42-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com