
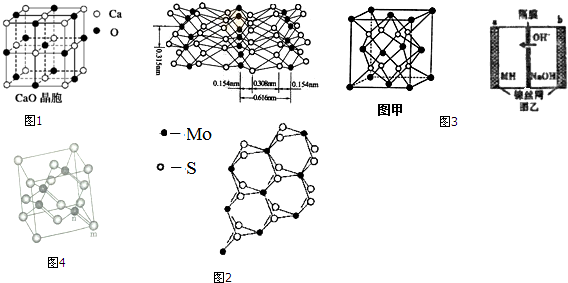
分析 (1)某Cr的配合物K[Cr(C2O4)2(H2O)2]中,配体为C2O42-、H2O,配体中O原子含有孤对电子;
原子数目相等、价电子总数相等的微粒互为等电子体,1个C原子与1个负电荷可以用N原子替换;
(2)微粒半径、所带电荷晶格能,电荷起主要作用;
(3)在NaN3固体中阴离子为N3-,与CO2互为等电子体,结构相似;
(4)①A.晶体硅中硅原子与周围4个Si原子形成4个Si-Si键;
B.非金属性越强,电负性越大;
C.晶体硅属于原子晶体,C60属于分子晶体;
D.Mo元素基态原子的价电子排布式为4d55s1,位于第五周期VIB族;
E.根据图2中下图可知MoS2的晶体中每个Mo原子周围距离最近的S原子数目为6;
F.范德华力不属于化学键;
②MoS2具有层状结构,Mo与S同层间以共价键结合,层与层之间通过范德华力结合,在外力作用下层与层间易发生相对滑动;
(5)根据均摊法计算晶胞中Fe、Mg原子数目,进而确定化学式;
A.放电时正极发生还原反应,反应为NiOOH获得电子生成Ni(OH)2;
B.b为正极,a为负极,电子由负极通过导线流向正极;
C.充电时为电解池,两极名称为阳极、阴极,放电时原电池的负极发生氧化反应;
D.储氢材料中储氢密度越大,电池的比能量越高;
(6)m位置Ga原子,n位置As原子,利用均摊法可知,计算晶胞中含有Ga原子、As原子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算;
Ga原子与As原子之间的距离应为晶胞体对角线长度的$\frac{1}{4}$倍,所以晶胞的体对角线为晶胞棱长的$\sqrt{3}$倍.
解答 解:(1)某Cr的配合物K[Cr(C2O4)2(H2O)2]中,配体为C2O42-、H2O,配体中O原子含有孤对电子,
原子数目相等、价电子总数相等的微粒互为等电子体,1个C原子与1个负电荷可以用N原子替换,与C2O42-互为等电子体的分子为N2O4,
故答案为:2;O;N2O4;
(2)晶体中阴阳离子所带电荷数CaO大于NaCl,所以CaO的晶格能大于NaCl的,
故答案为:晶体中阴阳离子所带电荷数CaO大于NaCl;
(3)在NaN3固体中阴离子为N3-,与CO2互为等电子体,结构相似,为直线形结构,
故答案为:直线形;
(4)①A.晶体硅中每个硅原子和4个硅原子能形成4个共价键,所以每个硅原子含有4个σ键且不含孤电子对,含有4个共价键的原子采用sp3杂化,故A错误;
B.元素的非金属性越强其电负性越大,S元素的非极性大于C元素,所以电负性:C<S,故B正确;
C.硅晶体属于原子晶体,C60晶体中存在分子间作用力,所以硅晶体熔点高于C60,故C错误;
D.Mo元素基态原子的价电子排布式为4d55s1,位于第五周期VIB族,故D正确;
E.根据图知,每个Mo原子周围距离最近的S原子数目是6,故E错误;
F.提供空轨道和提供孤电子对的原子间易形成配位键,配位键属于共价键,不同元素之间易形成的配位键属于极性共价键,范德华力不属于化学键,故F错误;
故答案为:BD;
②MoS2结构和石墨相似,根据图片知,MoS2具有层状结构,Mo和S同层间以共价键结合,层与层之间通过范德华力结合,外力作用层与层易发生相对滑动,
故答案为:MoS2具有层状结构,Mo与S同层间以共价键结合,层与层之间通过范德华力结合,在外力作用下层与层间易发生相对滑动;
(5)根据均摊法可知,晶胞中Fe原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Mg原子数目为8,故化学式为:Mg2Fe,
A.放电时正极发生还原反应,反应为NiOOH+H2O+e-=Ni(OH)2+OH-,故A正确;
B.为b为正极,a为负极,电子由负极通过导线流向正极,故B错误;
C.充电时为电解池,两极名称为阳极、阴极,放电时负极发生氧化反应,反应为:MH+OH--e-=M+H2O,故C错误;
D.M为储氢合金,储氢材料氢密度越大,电池的比能量密度越高,故D正确,
故答案为:Mg2Fe;BC;
(6)m位置Ga原子,n位置As原子,晶胞中含有Ga原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,As原子数目为4,晶胞质量为:4×$\frac{70+75}{6.02×1{0}^{23}}$g,则晶胞密度为4×$\frac{70+75}{6.02×1{0}^{23}}$g÷(565×10-10 cm)3=5.34g.cm-3,
Ga原子与As原子之间的距离应为晶胞体对角线长度的$\frac{1}{4}$倍,所以晶胞的体对角线为晶胞棱长的$\sqrt{3}$倍,则m位置Ga原子与n位置As原子之间的距离为$\frac{\sqrt{3}}{4}$×565 pm,
故答案为:4×$\frac{70+75}{6.02×1{0}^{23}}$÷(565×10-10 )3=5.34;$\frac{\sqrt{3}}{4}$×565.
点评 本题是对物质结构与性质的考查,涉及配合物、等电子体、空间构型、晶体结构与晶胞计算、原电池与电解原理等,需要学生具备扎实的基础,难度较大.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
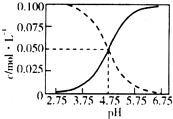 25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )
25℃时,c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的醋酸、醋酸钠混合溶液中,c(CH3COOH)、c(CH3COO-)与pH的关系如图所示.下列叙述正确的是( )| A. | 25℃时,CH3COOH的电离常数K的值5×10-2.75 | |
| B. | 随pH增大,$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$增大 | |
| C. | pH=4的溶液中,c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | pH=5的溶液中,c(H+)+c(Na+)+c(CH3COOH)-c(OH-)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
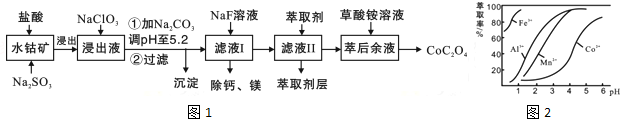
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑦⑧ | B. | ②③④⑥⑦ | C. | ③④⑥⑦⑧ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,你认为该分子是否为平面形分子?否(填“是”或“否”).
,你认为该分子是否为平面形分子?否(填“是”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、CH3CH2CH2CHO.
、CH3CH2CH2CHO.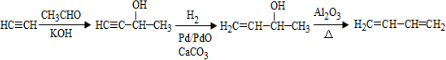 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物中含有0.05molFe元素 | |
| B. | 该硝酸溶液中溶质的质量分数是63% | |
| C. | 所加入NaOH溶液的体积最少是450mL | |
| D. | 反应中HNO3被氧化,生成氧化产物NO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com