
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A. 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 |
a.溶液pH=8 | i. S2O32-+H2O?HS2O3-+OH- S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b. 有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 |
ii.S2O32一+2H+═ S↓+SO2↑+H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii. S2O32-+4C12+5H2O=2SO42-+8C1-+10H+ S2O32-+4C12+5H2O=2SO42-+8C1-+10H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验操作 | 实验现象或预期实验现象 | 现象解释(用离子方程式表示) | |
| A. 用玻璃棒蘸取Na2S2O3溶液,点滴到pH试纸的中央,将试纸呈现的颜色与标准比色卡对照 用玻璃棒蘸取Na2S2O3溶液,点滴到pH试纸的中央,将试纸呈现的颜色与标准比色卡对照 |
溶液pH=8 | ||
| 猜想② | 向pH=2的硫酸中滴加Na2S2O3溶液 | B. 有淡黄色沉淀和无色刺激性气味气体产生 有淡黄色沉淀和无色刺激性气味气体产生 |
S2O32-+2H+═S↓+S02↑+H2O |
| 猜想③ | 向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | 氯水颜色变浅 | C. S2O32-+4C12+5H2O═2SO42-+8C1-+10H+ S2O32-+4C12+5H2O═2SO42-+8C1-+10H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:


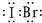
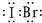
查看答案和解析>>
科目:高中化学 来源: 题型:
(2)新制氯水呈______色,说明氯水中有_______存在,在氯水中滴入数滴石蕊试剂,溶液变_____色,说明氯水中有_________存在,稍振荡颜色_______,说明氯水中有___________存在;久置的氯水颜色变浅,其原因是(用化学方程式表示)____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com