
| A. | 溶液中c(H+)和c(OH-)都减小 | B. | 溶液中c(H+)增大 | ||
| C. | 醋酸电离平衡向左移动 | D. | 溶液的pH增大 |
分析 A.稀释醋酸促进醋酸电离,溶液中氢离子浓度减小,根据水的离子积常数判断氢氧根离子浓度是否变化;
B.稀释后溶液中氢离子浓度减小;
C.稀释后醋酸的电离程度增大;
D.稀释后溶液中氢离子浓度减小,则溶液的pH增大.
解答 解:A.稀释醋酸促进醋酸电离,溶液中氢离子浓度减小,温度不变,水的离子积常数不变,则溶液中氢氧根离子浓度增大,故A错误;
B.醋酸被稀释后其电离程度增大,但是溶液中氢离子浓度减小,故B错误;
C.稀释过程中醋酸的电离程度增大,则电离平衡向右移动,故C错误;
D.醋酸被稀释后,溶液中氢离子浓度减小,则溶液的酸性减弱,pH增大,故D正确;
故选D.
点评 本题考查了弱电解质的电离平衡及其影响,题目难度中等,明确弱电解质电离特点是解本题关键,注意稀释醋酸溶液时,虽然促进醋酸电离,但氢离子浓度减小,很多同学往往认为促进醋酸电离,则氢离子浓度增大而导致错误,试题培养了学生的分析能力及灵活应用能力.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:选择题
| A. | c(H+)•c(OH-) | B. | $\frac{c{({CH}_{3}COO}^{-})•c{(H}^{+})}{c({CH}_{3}COOH)}$ | ||
| C. | $\frac{c{(H}^{+})}{c({CH}_{3}COOH)}$ | D. | $\frac{c({CH}_{3}C{OO}^{-})}{c{(OH}^{-})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q3-Q2+3 Q1 | B. | Q3+Q2+Q1 | C. | 3Q3-Q2+Q1 | D. | Q2-Q3+3 Q1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XY3 | B. | XY | C. | X3Y | D. | X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 滴定管装液滴定时应先用标准溶液润洗 | |
| C. | 蒸馏时温度计的水银球处于蒸馏烧瓶支管附近 | |
| D. | 锥形瓶用作反应容器时,一定不能加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
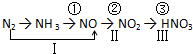
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
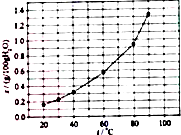
| A. | 溴酸银的溶解是吸热过程 | |
| B. | 温度升高时溴酸银溶解速度加快 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-3 | |
| D. | 若硝酸钾中含有少量溴酸银,可用它们的溶解度随温度变化的差异进行分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 | |
| B. | 用托盘天平称量氢氧化钠时,直接放在托盘上称量 | |
| C. | 用稀硫酸洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 取用化学药品时,应特别注意观察药品包装上的安全警示标志 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com