
| A. | SO3 | B. | NO2 | C. | Al2O3 | D. | SO2 |
分析 0.1mol下列气体分别与1L0.1mol•L-1的NaOH溶液反应,二者的物质的量相同,
SO3与NaOH等物质的量反应的方程式为NaOH+SO3=NaHSO4;
NO2与NaOH等物质的量反应的方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O;
Al2O3与NaOH等物质的量反应,氧化铝过量,NaOH完全反应,化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O;
与SO2与NaOH等物质的量反应的方程式为NaOH+SO2=NaHSO3;
解答 解:0.1mol下列气体分别与1L0.1mol•L-1的NaOH溶液反应,二者的物质的量相同,
A、SO3与NaOH等物质的量反应的方程式为NaOH+SO3=NaHSO4,NaHSO4在溶液中完全电离出氢离子,溶液显强酸性;
B、NO2与NaOH等物质的量反应的方程式为:2NO2+2NaOH=NaNO2+NaNO3+H2O,NaNO2为强碱弱酸盐,溶液显碱性;
C、Al2O3与NaOH等物质的量反应,氧化铝过量,NaOH完全反应,化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,所得溶液为NaAlO2溶液,而NaAlO2为强碱弱酸盐,水解显碱性;
D、SO2与NaOH等物质的量反应的方程式为NaOH+SO2=NaHSO3,NaHSO3在溶液中即电离又水解,电离程度大于水解程度,溶液显弱酸性;
综上可知,形成的溶液pH最小的是SO3;
故选A.
点评 本题考查了物质的性质,题目涉及元素化合物的性质、盐的水解、弱电解质的电离,题目难度中等,注意根据物质之间反应判断产物以及溶液的酸碱性.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
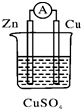
| A. | 电流从锌电极通过电流表流向铜电极 | |
| B. | 锌电极发生还原反应,铜电极发生氧化反应 | |
| C. | 当有13 g Zn溶解时,外电路中就有0.4 mol电子通过 | |
| D. | 铜电极作正极,发生的电极反应为2H++2e-═H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
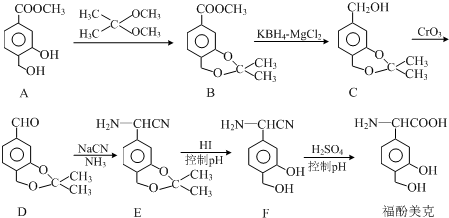
 .
.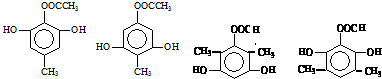 任意一种.
任意一种.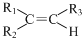 $→_{②Zn/H_{20}}^{①O_{3}}$
$→_{②Zn/H_{20}}^{①O_{3}}$ 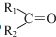 +R3CHO,根据已有知识并结合相关信息,写出以
+R3CHO,根据已有知识并结合相关信息,写出以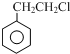 为原料制备
为原料制备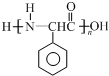 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
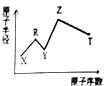 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T化合物能破坏水的电离子平衡.六种元素的原子半径与原序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 与同主族元素的氢化物相比较,R和Y的氢化物最稳定 | |
| C. | 最高价氧化物对应的水化物的酸性:T<R | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaHS溶液中HS-和S2-离子数之和为0.1NA | |
| B. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| C. | 1 mol Na2O2固体中含离子总数为4NA | |
| D. | 3 mol Fe在足量的水蒸气中完全反应转移9NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
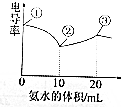 电导率可用于衡量电解质溶液导电能力的大小.室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100mol/L的盐酸和醋酸的混合液,电导率曲线如图所示.下列说法错误的是( )
电导率可用于衡量电解质溶液导电能力的大小.室温下,用0.1000mol/L氨水滴定10mL浓度均为0.100mol/L的盐酸和醋酸的混合液,电导率曲线如图所示.下列说法错误的是( )| A. | ①点溶液中c(H+)为0.200 mol/L | |
| B. | ②点溶液中c(Cl-)>c(NH4+)>c(Ac-) | |
| C. | ①点溶液中n(所有离子)之和>③点溶液n(所有离子)之和 | |
| D. | ③点后会出现pH=7的点,此点溶液中c(NH4+)=c(Ac-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
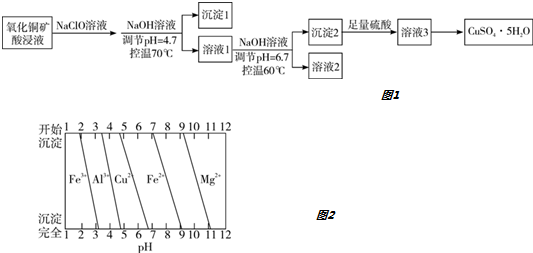
| A. | 沉淀1的主要成分为Al(OH)3和Fe(OH)3 | |
| B. | 溶液2中所含金属阳离子只有Mg2+ | |
| C. | 将溶液3蒸干即得CuSO4•5H2O晶体 | |
| D. | 若不加入NaClO溶液,对制得硫酸铜晶体的纯度将无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | 实验原理 | |
| A | 提纯混有少量硝酸钾的氯化钠 | 在较高温度下制得浓溶液再冷却结晶、过滤、干燥 | 氯化钠溶解度随温度升高变化不大,而硝酸钾溶解度随温度升高显著增大 |
| B | 配制FeCl3溶液 | 将FeCl3固体溶解于适量硫酸溶液 | H+抑制FeCl3水解 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | NH3溶于水后溶质的主要存在形式是NH4+、OH- |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡 | 3Mg(OH)2+2Fe3+?2Fe(OH)3+3Mg2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com