
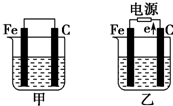
 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:分析 (1)①甲为原电池装置,铁作负极,则石墨作正极,正极上氧气得电子;
②Cl2氧化了生成的I2,Cl元素的化合价降低,由电子守恒及Cl2和I2的物质的量之比为5:1来判断反应后I元素的化合价,以此来书写化学反应;
③乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,根据电解方程式中电子与氢氧根离子的关系计算;
(2)①甲为原电池装置,铁作负极,铁失电子;
②乙装置中阳极上氢氧根离子失电子生成氧气,阴极上铜离子得电子生成Cu;
③根据电解硫酸铜的化学反应及元素守恒来判断加入的物质使溶液恢复到电解前的状态,再由溶液的pH的变化计算加入物质的质量.
解答 解:(1)①甲为原电池装置,石墨棒上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3,
故答案为:5Cl2+I2+6H2O═10HCl+2HIO3;
③乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,电解反应为2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,当乙反应有0.01mol电子转生成氢氧根离子为0.01mol,则氢氧根离子的浓度为0.1mol/L,所以溶液的pH=13;
故答案为:13;
(2)①甲为原电池装置,铁作负极,负极反应为Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
②乙装置中阳极上氢氧根离子失电子生成氧气,阴极上铜离子得电子生成Cu,其电解反应的离子方程式为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$ 2Cu+O2↑+4H+;
故答案为:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$ 2Cu+O2↑+4H+;
③由2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.1L×0.1mol/L=0.01mol,则由电解反应可知析出的Cu的物质的量为0.005mol,由Cu原子守恒可知,m(CuO)=0.005mol×80g/mol=0.4g,或m(CuCO3)=0.005mol×124g/mol=0.62g,
故答案为:CuO(或CuCO3);0.4(或0.62).
点评 本题考查原电池与电解池的工作原理,明确离子放电顺序、电极反应式的书写即可解答,注意电子守恒在计算中的应用,侧重于考查学生的分析能力和计算能力,题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Z>Y>X | |
| B. | 最高价氧化物对应水化物的酸性:Z>X>Y | |
| C. | 工业上可通过电解Y的盐溶液来制备Y的单质 | |
| D. | 氧元素分别与X、Y、Z形成的化合物都不止一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①中阴极上析出红色固体 | |
| B. | 装置②的待镀铁制品应与电源负极相连 | |
| C. | 装置③中a为负极,发生的电极反应式为H2+2OH-+2e-═2H2O | |
| D. | 装置④中在阴极可以得到氢气和氢氧化钠,离子交换膜可选用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
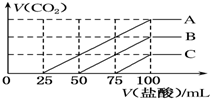 浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100mL倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐滴加入0.2mol•L-1的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2 mol•L-1 | |
| B. | B烧杯中通入的CO2体积为448 mL | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分为NaOH和 Na2CO3,且物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配置硫酸溶液时,将浓硫酸慢慢注入盛有水的容量瓶中进行配制 | |
| B. | 用托盘天平称量8.75g NaCl固体 | |
| C. | 将混合液蒸馏分离时,应使温度计水银球浸没在混合液中 | |
| D. | 分液时,将上层液体从分液漏斗上口倒出,下层液体从分液漏斗下口放出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com