
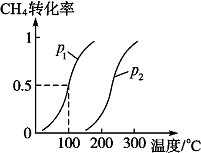
 将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.
将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应Ⅱ:CH4(g)+H2O(g)?CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图.| △c |
| △t |
| c(CO)c3(H2) |
| c(CH4)×c(H2O) |
| 1.0mol×0.5 |
| 100L |
| 0.005mol/L |
| 5min |
| c(CO)c3(H2) |
| c(CH4)×c(H2O) |
| ||||
|


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前10min反应的平均速率V(C)=0.10mol/L?min |
| B、10min后向容器中加入A,重新平衡时A的转化率一定大于50% |
| C、恒温下将反应容器体积缩小一半,则D的平衡浓度小于1.0mol/L |
| D、反应达平衡时B的平衡浓度是1.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、40 | B、48 | C、41 | D、49 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | I1 | I2 | I3 | I4 |
| E | 500 | 4600 | 6900 | 9500 |
| F | 740 | 1500 | 7700 | 10500 |
| H | 580 | 1800 | 2700 | 11600 |
| I | 420 | 3100 | 4400 | 5900 |
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铜丝在氧气中燃烧生成是CuO,则铁丝在氧气中燃烧生成Fe2O3 |
| B、少量CO2通入NaOH溶液中生成Na2CO3,则少量CO2通入C6H5ONa溶液中也生成Na2CO3 |
| C、甲醛能发生银镜反应,则甲酸甲酯也能发生银镜反应 |
| D、金刚石的硬度大,则C60的硬度也大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com