
【题目】巳知:25℃时某些弱酸的电离平衡常数。下面图像表示常温下稀释CH3COOH、HClO两种酸的稀溶液时、溶液pH随加水量的变化,下列说法正确的是
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-3 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |

A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32-
C. 图像中a点酸的总浓度大于b点酸的总浓度
D. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
【答案】D
【解析】A. 酸性:CH3COOH>HClO,所以水解程度:CH3COONa<NaClO,因此,相同浓度CH3COONa和NaClO的混合液中各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),故A错误;B. 酸性:H2CO3>HClO> HCO3-,所以向NaClO溶液中通入少量二氧化碳的离子方程式为:ClO-+CO2+H2O=HClO+HCO3-,故B错误;C. 图像中pH变化较快的酸的酸性较强,浓度较小,所以a点酸的总浓度小于b点酸的总浓度,故C错误;D. 图像中a、c两点处的溶液中盐的水解常数相等,所以![]() 相等,故D正确。故选D。
相等,故D正确。故选D。


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:
【题目】阅读下列实验内容,根据题目要求回答问题:
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14 mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果_____________(填“偏小”、“偏大”或“无影响”)。
(2)配制稀H2SO4溶液,必须使用的主要容器是_________________。
(3)计算待测硫酸溶液的物质的量浓度(计算结果保留到小数点后第二位)___________。
(4)欲配制0.175mol/L醋酸钠溶液500mL,可采用以下两种方案:
方案一:用托盘天平称取_______g无水醋酸钠,溶于适量水中,配成500mL溶液。
方案二:用体积均为250 mL且浓度均为________的醋酸与氢氧化钠两溶液混合而成(设混合后的体积等于混合前两者体积之和)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强碱性溶液中,下列离子组能大量共存的是( )
A.Na+、K+、SO42﹣、Cl﹣
B.Na+、Cu2+、SO42﹣、NO3﹣
C.Mg2+、Na+、SO42﹣、Cl﹣
D.Ba2+、HCO3﹣、NO3﹣、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是25℃时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=2.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B. 向浓度均为l×10-3mol/L的KCl和K2CrO4混合液中滴加l×10-3mol/LAgNO3溶液,CrO42-先形成沉淀
C. 碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2+H2O=HCO3-+Cl-+HClO
D. 向0.1mol/LCH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况右图所示,回答下列问题。
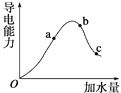
(1)“O”点时液体不能导电,说明醋酸中________离子键(填“含有”或“不含”)。
(2)a、b、c三点醋酸电离程度由大到小的顺序为________;a、b、c三点对应的溶液中c(H+)最大的是________。
(3)要使c点溶液中c(CH3COO-)增大而c(H+)减小,可采取的两种措施是______________。
(4)若实验测得c点处溶液中c(CH3COOH)=0.1 mol·L-1,c(CH3COO-)=0.001 mol·L-1,则该条件下CH3COOH的电离常数Ka=________。
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是________________
A.c(H+) B.H+个数
C.CH3COOH分子数 D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证同主族元素性质的递变规律。某小组用如图所示的装置进行实验(夹持仪器已略去,装置气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当装置B和装置C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当装置B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)浸有NaOH溶液的棉花的作用____________________________。
(2)装置A中发生的置换反应的化学方程式为___________________。
(3)装置B的溶液中NaBr完全被氧化,则消耗Cl2的物质的量为__________。
(4)为验证溴元素的非金属性强于碘元素,过程Ⅳ的操作和现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某磁流体的分散质粒子直径在5.5~36 nm之间。下列说法正确的是
A.此磁流体是溶液B.此磁流体是悬浊液
C.此磁流体很不稳定D.当一束强光通过此磁流体时会出现光亮的通路
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质呈现周期性变化的根本原因是
A. 原子半径呈周期性变化
B. 元素的化合价呈周期性变化
C. 第一电离能呈周期性变化
D. 元素原子的核外电子排布呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语表示正确的是:
A. CO2分子的球棍模型:![]() B. 14N 的原子结构示意图:
B. 14N 的原子结构示意图:![]()
C. CH4分子的比例模型:  D. 质子数为6,中子数为8 的核素:l4C
D. 质子数为6,中子数为8 的核素:l4C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com