
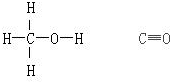
| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| 键能(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
分析 (1)反应热=反应物总键能-生成物总键能;
(2)依据化学平衡三段式列式计算,经过10min后达到平衡状态.若此时测得CH3OH蒸气的浓度为0.5mol/L.物质的量为0.5L×2mol/L=1mol;
3H2(g)+?CO2(g)?CH3OH(g)+H2O(g)
起始量(mol) 4 2 0 0
变化量(mol) 3 1 1 1
平衡量(mol) 1 1 1 1
据此计算反应速率V=$\frac{△c}{△t}$,
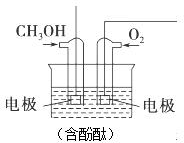
(3)通入甲醇的电极是负极,反应时该电极反应:CH3OH+8OH--6e-=CO32-+6H2O,故溶液红色变浅;该燃料电池工作时,阳离子向正极移动,电解质溶液为碱性,所以电池正极的电极反应式为:O2+2H2O+4e-=4OH-;根据串联电路中转移电子相等计算消耗氧气的量;
解答 解:(1)反应热=反应物总键能-生成物总键能,故△H=1076kJ.mol-1+2×436kJ.mol-1-(3×413+343+465)kJ.mol-1=-99kJ.mol-1;
故答案为:放出; 99
(2)经过5min后达到平衡状态.若此时测得CH3OH蒸气的浓度为0.5mol/L.物质的量为0.5L×2mol/L=1mol;
3H2(g)+?CO2(g)?CH3OH(g)+H2O(g)
起始量(mol) 4 2 0 0
变化量(mol) 3 1 1 1
平衡量(mol) 1 1 1 1
据此计算以H2的浓度变化表示的该反应反应速率V=$\frac{\frac{3mol}{2L}}{10min}$=0.15mol/(L•min),
故答案为:0.15mol/(L•min);
(3)通入甲醇的电极是负极,反应时该电极反应:CH3OH+8OH--6e-=CO32-+6H2O,故溶液红色变浅;该燃料电池工作时,阳离子向正极移动,氧气在碱性电解质溶液中得电子,所以电池正极的电极反应式为:O2+2H2O+4e-=4OH-,电池工作过程中通过2mol电子,则理论上消耗O2的体积=$\frac{2mol}{4}$×22.4L/mol=11.2L
故答案为:负;溶液红色变浅;正;O2+2H2O+4e-=4OH-;11.2L.
点评 本题考查了原电池原理,涉及电极反应式的书写、热化学反应方程式、物质的量的计算等知识点,这些知识点都是考试热点,根据串联电路中转移电子相等进行计算,难点是电极反应式的书写,题目难度中等.


科目:高中化学 来源: 题型:解答题
温度/K | 298 | 398 | 498 | … |
| 平衡常数(K) | 4.1×105 | K1 | K2 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | C-H | C-C | C═C | H-H |
| 键能/kJ•mol-1 | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
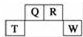 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应Ⅱ | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
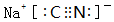 .
.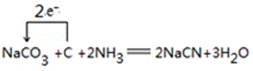 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘天平 | B. | 胶头滴管 | C. | 250 mL容量瓶 | D. | 量筒 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com