
 ��֪���25��ʱijЩ����ĵ���ƽ�ⳣ������ͼ��ʾ����ʱ��ϡ��CH3COOH��HClO�������ϡ��Һʱ����ҺpH���ˮ���ı仯������������Ϣ������˵����ȷ���ǣ�������
��֪���25��ʱijЩ����ĵ���ƽ�ⳣ������ͼ��ʾ����ʱ��ϡ��CH3COOH��HClO�������ϡ��Һʱ����ҺpH���ˮ���ı仯������������Ϣ������˵����ȷ���ǣ�������| CH3COOH | HClO | H2CO3 |
| Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.4��10-7 Ka2=4.7��10-11 |
| A�� | ��ͼ�е�������ֱ�͵�Ũ�ȵ�NaOH��Һ�պ���ȫ��Ӧ�����ļ�������� | |
| B�� | ��NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��2ClO-+CO2+H2O�T2HClO+CO32- | |
| C�� | a��b��c������ʾ��Һ��ˮ�ĵ���̶�c��a��b | |
| D�� | ͼ���У����ʾCH3COOH�����ʾHClO������Һ�����ԣ�c��b��a |
���� A��PHֵ��ͬ������ƽ�ⳣ��ԽС�����Ũ��Խ��
B������ǿ��H2CO3��HClO��HCO3-������ǿ����ȡ����֪�����߷�Ӧ����̼�����ƺʹ����
C������Һ��������Ũ��ԽС��������ˮ����̶�ԽС��
D��pH��ȵ�CH3COOH��HClO��ϡ����ͬ�ı���ʱ����ǿ����������Ũ��С�ڽ����ᣬ��������pHС�ڽ�ǿ�ᣬ��������Ũ��Խ��������Һ�ĵ�����Խǿ��
��� �⣺A��PHֵ��ͬ������ƽ�ⳣ��ԽС�����Ũ��Խ�����Դ��������ļ��������ڴ��ᣬ��A����
B������ǿ��H2CO3��HClO��HCO3-������ǿ����ȡ����֪�����߷�Ӧ����̼�����ƺʹ����ᣬ���ӷ���ʽΪClO-+CO2+H2O�THClO+HCO3-����B����
C������Һ��������Ũ��ԽС��������ˮ����̶�ԽС��a��b��c������Һ��C��H+����С˳����b��a��c������ˮ����̶�c��a��b����C��ȷ��
D��pH��ȵ�CH3COOH��HClO��ϡ����ͬ�ı���ʱ����ǿ����������Ũ��С�ڽ����ᣬ��������pHС�ڽ�ǿ�ᣬ����CH3COOH��HClO������I��ʾCH3COOH�����ʾHClO����������Ũ��Խ��������Һ�ĵ�����Խǿ��������Һ�����ԣ�b��a��c����D����
��ѡC��
���� ���⿼����������ʵĵ��룬������ĵ��볣�����������ˮ��̶ȡ��������ǿ����֪ʶ�����������ע�⣺��Һ����������С����Һ�������ƶ����ӳ����ȣ�������ǿ���أ�Ϊ�״��㣮


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
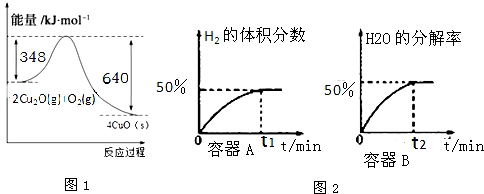
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ʵ���Ũ��c���ף�=10c���ң� | |
| B�� | ������ˮ���������H+�����ʵ���Ũ�Ⱥ��ҵ���� | |
| C�� | �к͵����ʵ���Ũ�ȵ������NaOH��Һ��ס�����������V���ң���10V���ף� | |
| D�� | ���е�c��OH-��Ϊ����c��OH-����10�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��CH3COOH��Һ������ʵ�飬���ݺܰ���֤��CH3COOH��������� | |
| B�� | pH��ͬ�Ĵ�������ᣬȡ���������������Һ�ֱ�ϡ����ԭ��Һ�����m����n����ϡ�ͺ�����Һ��pH��Ȼ��ͬ����m��n | |
| C�� | �����£���0.10 mol•L-1��NH3•H2O��Һ�м�������NH4Cl���壬��ʹ��Һ��pH��С��c��NH4+��/c��NH3•H2O����ֵ���� | |
| D�� | �����£�CH3COOH��Ka=1.7��10-5��NH3•H2O��Kb=1.7��10-5��CH3COOH��Һ�е�c��H+����NH3•H2O����Һ�е�c��OH-����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
 ��ͼ�Dz�����Һ�õ������ǣ�����ʽΪC6H12O6��ע��Һ�ı�ǩ�ϵIJ������ݣ��ݱ�ǩ���ṩ����Ϣ������˵��������ǣ�������
��ͼ�Dz�����Һ�õ������ǣ�����ʽΪC6H12O6��ע��Һ�ı�ǩ�ϵIJ������ݣ��ݱ�ǩ���ṩ����Ϣ������˵��������ǣ�������| A�� | ��ע��Һ�������ǵ�����������5% | |
| B�� | �����ǵ�Ħ������Ϊ180g•mol-1 | |
| C�� | ��ע��Һ���ܶ�ԼΪ1g•mL-1 | |
| D�� | ��ע��Һ�������ǵ����ʵ���Ũ��ԼΪ0.014 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 12gʯī��C60�Ļ�Ϲ����У���NA��̼ԭ�� | |
| B�� | ��״���£�2.24Lˮ�к���0.1NA��ˮ���� | |
| C�� | 7.8g�������ƺ��еĹ��õ��Ӷ���Ϊ0.2NA | |
| D�� | 5.6g��������������ȼ�գ�����ת����ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ų���Һ�ĵζ��ܿ�ʼ�����ݣ�����Һ���������ʧ | |
| B�� | �ζ���������ˮϴ�Ӻ�ֱ��ע�����Һ���еζ� | |
| C�� | ��ƿ������ˮϴ�Ӻ�ֱ�Ӽ��������Һ�ζ� | |
| D�� | �ζ���������ˮϴ�Ӻ�ֱ��ע�����Һ��ȡ20.00 mL���еζ� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com