
【题目】A、B、C、D为前四周期元素.A元素的原子价电子排布为![]() ,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的P轨道中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
![]() 当
当![]() 时,
时,![]() 属于 ______ 分子
属于 ______ 分子![]() 填“极性”或“非极性”
填“极性”或“非极性”![]() .
.
![]() 当
当![]() 时,A与B形成的晶体属于 ______ 晶体.
时,A与B形成的晶体属于 ______ 晶体.
![]() 若A元素的原子价电子排布为
若A元素的原子价电子排布为![]() ,A、C、D三种元素的第一电离能由大到小的顺序是 ______
,A、C、D三种元素的第一电离能由大到小的顺序是 ______ ![]() 用元素符号表示
用元素符号表示![]() 。
。
![]() 已知某红紫色配合物的组成为
已知某红紫色配合物的组成为![]() 该配合物中的中心离子钴离子在基态时核外电子排布式为 ______ ,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质化学式是 ______ 。
该配合物中的中心离子钴离子在基态时核外电子排布式为 ______ ,又已知中心离子钴离子的配位数是6,1mol该物质与足量的硝酸银反应可生成3molAgCl,则该物质化学式是 ______ 。
![]() 金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ______ 。
金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 ______ 。

【答案】非极性 原子 ![]()
![]() 或
或![]()
![]() 1:2
1:2
【解析】
A、B、C、D为前四周期元素,A元素的原子价电子排布为![]() ,当
,当![]() 时,A是C元素,如果
时,A是C元素,如果![]() 时,则A是Si元素,如果
时,则A是Si元素,如果![]() 时,则A是Ge元素; B元素的最外层电子数是其电子层数的3倍,最外层电子数不超过8个,K层不超过2个,则B最外层电子数是6,为O元素; C元素原子的M电子层的P轨道中有3个未成对电子,则C是P元素; D元素原子核外的M层中只有2对成对电子,则D是S元素;
时,则A是Ge元素; B元素的最外层电子数是其电子层数的3倍,最外层电子数不超过8个,K层不超过2个,则B最外层电子数是6,为O元素; C元素原子的M电子层的P轨道中有3个未成对电子,则C是P元素; D元素原子核外的M层中只有2对成对电子,则D是S元素;
![]() 当
当![]() 时,A是C元素,B是O元素,分子中正负电荷重心重合的分子为非极性分子,不重合的分子为极性分子,二者生成的化合物二氧化碳为直线形分子,正负电荷重心重合,为非极性分子;
时,A是C元素,B是O元素,分子中正负电荷重心重合的分子为非极性分子,不重合的分子为极性分子,二者生成的化合物二氧化碳为直线形分子,正负电荷重心重合,为非极性分子;
故答案为:非极性;
![]() 当
当![]() 时,A是Si元素,A与B形成的化合物是二氧化硅,直接由原子构成的晶体是原子晶体,二氧化硅的构成微粒是原子,所以属于原子晶体;
时,A是Si元素,A与B形成的化合物是二氧化硅,直接由原子构成的晶体是原子晶体,二氧化硅的构成微粒是原子,所以属于原子晶体;
故答案为:原子;
![]() 若A元素的原子价电子排布为
若A元素的原子价电子排布为![]() ,则A是Si元素,Si、P、S是同一周期元素,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,P位于第VA族、S位于第VIA族、Si位于第IVA族,所以第一电离能大小顺序是
,则A是Si元素,Si、P、S是同一周期元素,同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,P位于第VA族、S位于第VIA族、Si位于第IVA族,所以第一电离能大小顺序是![]() ;
;
故答案为:![]() ;
;
![]() 根据构造原理书写钴离子在基态时核外电子排布式为
根据构造原理书写钴离子在基态时核外电子排布式为![]() 或
或![]() ; 中心离子钴离子的配位数是6,配合物中只有外界才能电离出自由移动的离子,1mol该物质与足量的硝酸银反应可生成3molAgCl,说明该配合物外界中含有3个氯离子,其配位数是6,则氨气分子和水分子都是其配体,则该配合物的化学式为
; 中心离子钴离子的配位数是6,配合物中只有外界才能电离出自由移动的离子,1mol该物质与足量的硝酸银反应可生成3molAgCl,说明该配合物外界中含有3个氯离子,其配位数是6,则氨气分子和水分子都是其配体,则该配合物的化学式为![]() ;
;
故答案为:![]() 或
或![]() ;
;![]() ;
;
![]() 体心立方中Fe原子个数
体心立方中Fe原子个数![]() ,面心立方中Fe原子个数
,面心立方中Fe原子个数![]() ,则体心立方、面心立方中铁原子个数之比
,则体心立方、面心立方中铁原子个数之比![]() :
:![]() :2;
:2;
故答案为:1:2;


科目:高中化学 来源: 题型:
【题目】某学生用碱式滴定管量取0.1 mol/L的NaOH溶液,开始时仰视液面读数为1.00 mL,取出部分溶液后,俯视液面,读数为11.00 mL,该同学在操作中实际取出的液体体积为( )
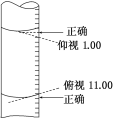
A.大于10.00 mLB.小于10.00 mL
C.等于10.00 mLD.等于11.00 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分反应的产物已略去)。A只含两种元素,摩尔质量为72g·mol1。B是无色气体,其水溶液是常见的酸,C是常见金属,E的组成元素与水相同,其水溶液常用于实验室制氧气,H的俗名是熟石灰,J为红褐色固体。

(1)A的化学式为___。
(2)D的电子式为___。
(3)写出反应③的离子方程式:___。
(4)写出反应④的化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体。合成肉桂酸甲酯的工业流程如下图所示:
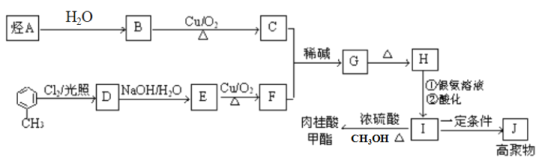
已知:I. 烃A在标准状况下的密度为1.25 g/L。
II.醛与醛能发生反应,原理如下:
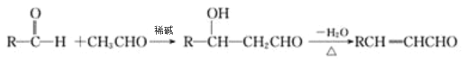
请回答:
(1)化合物H中的官能团为_____________________。
(2)肉桂酸甲酯的结构简式为_________________,J的结构简式为____________。
(3)G→H的反应类型为________。
(4)写出反应B→C的化学方程式___________________________。
(5)符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴发生加成
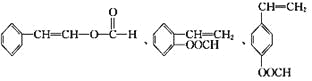 、_________、__________
、_________、__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1L的密闭容器中通入2mol NH3,在一定温度下发生下列反应:2NH3![]() N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内
N2+3H2,达到平衡时,容器内N2的百分含量为a%。若维持容器的体积和温度都不变,分别通入下列初始物质,达到平衡时,容器内![]() 的百分含量也为a%的是( )
的百分含量也为a%的是( )
A.3mol H2+2mol N2B.2mol NH3+1mol N2
C.3mol N2+1mol H2D.0.lmol NH3+0.95mol N2+2.85mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示装置的判断,叙述正确的是( )

A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中的电子流向是:a→Cu→经过CuSO4溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I已知:还原性HSO![]() >I-,氧化性IO
>I-,氧化性IO![]() > I2 。
> I2 。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式并用单线桥标出电子转移的方向和数目_______。
囗NaIO3+囗NaHSO3→ 囗I2+囗Na2SO4+囗H2SO4+囗H2O
(2)在含5molNaHSO3的溶液中逐滴加入NaIO3溶液。加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。写出反应过程中与AB段曲线对应的离子方程式_______;当溶液中I-与I2的物质的量之比为5:3时,加入的NaIO3为_______mol。

II 已知:KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2、KHSO4等物质。写出该反应的化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知气态烃A在标准状况下的密度是1.25g·L-1,B、C、D、E均为常见的有机物, 在一定条件下,它们有如下图所示的转化关系。

请回答:
(1) A分子中官能团的名称是_______,能与金属钠反应放出氢气的物质有______ (填字母)。
(2)反应⑤的化学方程式是____________________ ( 有机物用结构简式表示)。
(3)下列说法不正确的是___________
A.实验室制备D时将生成的D冷凝到装有水的试管里,以除去D中少量的杂质
B.反应④属于取代反应
C.相同物质的量的A、B或C充分燃烧时消耗等量的氧气
D.葡萄糖在一定条件下分解可以生成有机物B
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com