
| 选项 | 实验目的 | 实验设计 |
| A | 制备Fe(OH)3胶体 | 向0.1mol•L-1的FeCl3溶液中加入等体积0.3mol•L-1的NaOH溶液,煮沸 |
| B | 除去CO2中的HCl | 将混合气体依次通入Na2CO3溶液和浓硫酸中 |
| C | 检验溶液中是否含有SO42- | 取少量待检测溶液,向其中加入Ba(NO3)2溶液,再加入少量盐酸,观察实验现象 |
| D | 验证氧化性:Fe3+<Br2<Cl2 | 向试管中依次加入1mL0.1mol•L-1FeBr2溶液,几滴KSCN溶液和1mL苯,然后逐滴加入氯水,轻轻振荡,观察整个过程中有机相和水相中的现象 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.反应生成沉淀;
B.二氧化碳能与碳酸钠反应;
C.不能排除SO32-的影响;
D.同一氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性.
解答 解:A.反应生成沉淀,应向沸水中滴加饱和氯化铁溶液来制备胶体,故A错误;
B.二氧化碳能与碳酸钠反应,将原物质除掉,故B错误;
C.不能排除SO32-的影响,可被硝酸氧化生成SO42-,故C错误;
D.验证氧化性Fe3+<Br2<Cl2:向试管中依次加入1mL 0.1mol•L-1FeBr2溶液、几滴KSCN溶液和1mL苯,苯和水不互溶,二者分层且水在下层苯在上层,然后逐滴加入氯水,并缓缓振荡,直到氯水过量,氯水氧化亚铁离子生成铁离子而导致水层呈黄色,氯气氧化溴离子生成溴单质,溴单质易溶于苯而使苯层呈橙色,观察整个过程中有机相和水相中的现象,并根据颜色变化先后顺序确定氧化性强弱,故D正确.
故选D.
点评 本题考查化学实验方案评价,为高频考点,明确实验原理及物质性质是解本题关键,涉及氧化性强弱判断、离子检验、胶体制备、除杂等知识点,能从实验操作规范性及实验评价性分析判断,易错选项是D.


科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W | Q |
| 原子半径/pm | 160 | 143 | 70 | 66 | 102 |
| 主要化合价 | +2 | +3 | +5、-3 | -2 | +6、-2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 氢化物的沸点 H2W>H2Q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸或碱 | 电离常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 6.2×10-10 |
| HClO | 3×10-8 |
| NH3•H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1.1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 9.1×10-6 |
| CaCO3 | 2.8×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
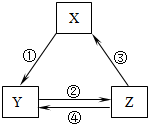 下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )
下表各组物质之间通过一步反应不可以实现如图所示的转化关系的是( )| 选项 | X | Y | Z | 箭头上所标数字的反应条件 |
| A | CaO | Ca(OH)2 | CaCO3 | ①常温遇水 |
| B | AlCl3 | NaAlO2 | Al(OH)3 | ②通入CO2 |
| C | Fe2O3 | FeCl3 | Fe(OH)3 | ③加入盐酸 |
| D | Cl2 | Ca(ClO)2 | HClO | ③加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
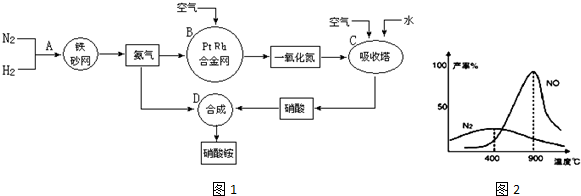
 4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.
4NO+6H2O,当温度高于900℃时,NO产率明显下降的原因是生成NO的反应为放热反应,升高温度转化率下降.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com