
分析 (1)根据水的硬度是由钙和镁的碳酸氢盐或氯化物等引起的,这种硬度叫做暂时硬度,加热煮沸后会生成碳酸钙和氢氧化镁沉淀;
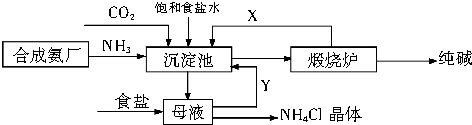
(2)在联合制碱法中,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,放出的二氧化碳气体可回收循环使用,其滤液是含有氯化铵和氯化钠的溶液,向含有氯化铵和氯化钠的滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品;
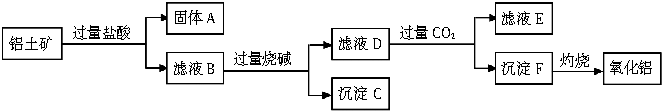
(3)由工艺流程甲可知,向铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中加入盐酸,铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3,氢氧化铝灼烧得氧化铝,据此答题.
解答 解:(1)根据水的硬度是由钙和镁的碳酸氢盐或氯化物等引起的,这种硬度叫做暂时硬度,加热煮沸后会生成碳酸钙和氢氧化镁沉淀,
故答案为:暂时;CaCO3;Mg(OH)2;
(2)在联合制碱法中,联合制碱法包括两个过程:第一个过程与氨碱法相同,将氨通入饱和食盐水而成氨盐水,再通入二氧化碳生成碳酸氢钠沉淀,经过滤、洗涤得NaHCO3微小晶体,再煅烧制得纯碱产品,放出的二氧化碳气体可回收循环使用,其滤液是含有氯化铵和氯化钠的溶液,向含有氯化铵和氯化钠的滤液中加入细粉状的氯化钠,并通入氨气,可以使氯化铵单独结晶沉淀析出,经过滤、洗涤和干燥即得氯化铵产品,
①由于氨气易溶于水,所以向沉淀池中通入NH3和CO2气体时,正确的顺序是先通入NH3至饱和后再通入CO2至饱和,
故答案为:先通入NH3至饱和后再通入CO2至饱和;
②根据上面的分析可知,流程图中X表示的物质是CO2,
故答案为:CO2;
(3)由工艺流程甲可知,向铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中加入盐酸,铝土矿与盐酸反应得固体A为滤液B,则固体A为SiO2,滤液B含有氯化铝、氯化铁、氯化镁等,滤液中加入过量的NaOH,可推知沉淀C为氢氧化铁、氢氧化镁,滤液D含有偏铝酸钠、氯化钠、NaOH,所以向滤液D中通入过量二氧化碳,生成氢氧化铝沉淀与碳酸氢钠,沉淀F为Al(OH)3,滤液E中含有NaCl、NaHCO3,氢氧化铝灼烧得氧化铝,
①根据上面的分析可知,固体A是SiO2,滤液E中含有的溶质是 NaCl和NaHCO3,
故答案为:SiO2; NaCl和NaHCO3;
②溶液的pH=13.0时,溶液中c(OH-)=0.1mol/L,由氢氧化镁溶度积常数计算镁离子浓度,Ksp=c(Mg2+)c2(OH-)=5.6×10-12 ,代入计算得到c(Mg2+)=5.6×10-10 mol/L,
故答案为:5.6×10-10.
点评 本题是一道综合题,涉及化学和生活、工业应用、工业流程、沉淀的溶解平衡计算等,能较好的考查学生分析和解决问题的能力,能较好地考查了元素及其化合物的相关性质,题目难度中等,答题时注意基础知识的灵活运用.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
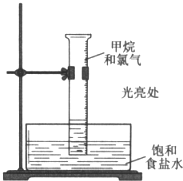 甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )
甲烷与氯气在光照条件下发生反应(装置如图),实验现象及解释均正确的是( )| 现象 | 解释 | |
| A. | 量筒内气体颜色逐渐变浅 | 甲烷被氯气还原 |
| B. | 量筒内出现少量白雾 | 生成HCl气体 |
| C. | 量筒内壁产生油状液滴 | 油状液体是CCl4 |
| D. | 量筒中液面降低 | 生成液态产物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通电时阴极附近溶液的酸性增强 | |
| B. | 铅蓄电池的A极为正极 | |
| C. | 通电时,H+由左至右通过质子交换膜 | |
| D. | 通电时,Pt电极的质量几乎不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHCO3═Na++H++CO32- | B. | H2SO4═2H++SO42- | ||
| C. | FeCl3═Fe3++Cl3- | D. | Ba(OH)2═Ba2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(H2)=0.2mol•L-1•min-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(N2)=0.02 mol•L-1•s-1 | D. | v(H2)=0.04 mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com