
【题目】在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
A. 向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明氯水的氧化性强于I2
B. 新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明Cl2有漂白性
C. 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl﹣
D. 向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
【答案】B
【解析】
试题氯气溶于水,部分发生反应:Cl2+H2O![]() H++Cl-+HClO ,所以在氯水中含有Cl2、HClO、H2O、H+、Cl-、ClO-、OH-多种微粒。A.向淀粉碘化钾溶液中加入氯水,发生反应Cl2+2KI=2KCl+I2,I2遇淀粉变蓝色,所以溶液变为蓝色,证明Cl2的氧化性强于I2,A项正确;B.新制氯水滴在蓝色石蕊试纸上,H+使试纸变红色,HClO具有强氧化性,能使变红了试纸褪色,实际上是HClO有漂白性,B项错误;C.向氯水中滴加硝酸酸化的AgNO3溶液,发生反应Cl-+Ag+=AgCl↓,产生白色沉淀,说明氯水中含有Cl-,C项正确;D.向氯水中加入NaHCO3粉末,发生反应HCO3-+H+=CO2↑+H2O,有气泡产生,说明氯水中含有H+,D项正确;答案选B。
H++Cl-+HClO ,所以在氯水中含有Cl2、HClO、H2O、H+、Cl-、ClO-、OH-多种微粒。A.向淀粉碘化钾溶液中加入氯水,发生反应Cl2+2KI=2KCl+I2,I2遇淀粉变蓝色,所以溶液变为蓝色,证明Cl2的氧化性强于I2,A项正确;B.新制氯水滴在蓝色石蕊试纸上,H+使试纸变红色,HClO具有强氧化性,能使变红了试纸褪色,实际上是HClO有漂白性,B项错误;C.向氯水中滴加硝酸酸化的AgNO3溶液,发生反应Cl-+Ag+=AgCl↓,产生白色沉淀,说明氯水中含有Cl-,C项正确;D.向氯水中加入NaHCO3粉末,发生反应HCO3-+H+=CO2↑+H2O,有气泡产生,说明氯水中含有H+,D项正确;答案选B。


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】中国的瓷器驰名世界,制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物 a(![]() )、b(
)、b(![]() )、c(
)、c(![]() )的说法正确的是
)的说法正确的是
A. a、b、c 的分子式均为 C8H8
B. a、b、c 均能与溴水发生反应
C. a、b、c 中只有 a 的所有原子可能会处于同一平面
D. a、b、c 的一氯代物中,b 有 1 种,a、c 均有 5 种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钾的冶炼可采用如下方法:2KF+CaC2![]() CaF2+2K↑+2C,下列有关说法合理的是( )
CaF2+2K↑+2C,下列有关说法合理的是( )
A.该反应的氧化剂是KF,氧化产物是K
B.该反应能说明C的还原性大于K
C.电解KF溶液不可能制备金属钾
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
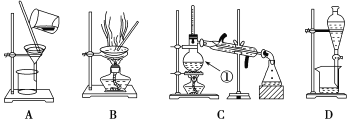
(1) 装置C中①的名称是____________,冷却水的方向是____________。
(2) 从氯化钠溶液中得到氯化钠固体,选择装置______(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置________,检验自来水中Cl-是否除净的方法为:取少量锥形瓶中的水于洁净试管中,滴加_________溶液,不产生白色沉淀表明Cl-已除净。
Ⅱ.从某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答:
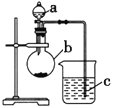
(1) 仪器a的名称是__________,应盛放下列药品中的__________(填字母);
A.稀硫酸 B.亚硫酸 C.氢硫酸 D.盐酸
(2) 仪器b的名称是__________,应盛放下列药品中的__________(填字母);
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3) 仪器c中应盛放的药品是__________,如果看到的现象是__________,证明b中反应产生了__________,即可证明_______比_________酸性强,得电子能力________比________强。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是 ( )

A. 简单离子的半径大小关系:C>E
B. D元素的气态氢化物比C元素的气态氢化物稳定
C. 由A、B、C二种元素组成的离子化合物中,阴、阳离子个数比为1:1
D. 由C、D、E二种元素组成的化合物,溶液显中性或碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 1 mol NH![]() 含有的电子数为10NA
含有的电子数为10NA
B. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
C. 1 L 0.1 mol·L-1氨水含有0.1NA个OH-
D. 50 mL 18.4 mol·L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物广泛存在于自然界中。回答下列问题:
(1)写出N原子的电子排布式_____________。在基态14N原子中,核外存在___________个未成对电子。
(2)原子第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,C、N、O原子的第一电离能由大到小的顺序为_______________。
(3)氮气和氢气在一定条件下可合成氨,氨分子中氮原子的杂化方式为_____________杂化。
(4)纯叠氮酸HN3在常温下是一种液体,沸点较高,为308.8K,主要原因是_________。
(5)X的+1价阳离子中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的元素符号是________,X离子与N3-形成的化合物化学式为____________。

(6)假设X+的半径为a cm,N3-的半径为b cm,且X+与N3-都是紧密接触的刚性小球,则该氮化物的密度为_____________g.cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com