
【题目】石棉尾矿主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾矿为镁源制备碳酸镁晶体(MgCO3·nH2O)的工艺如下:
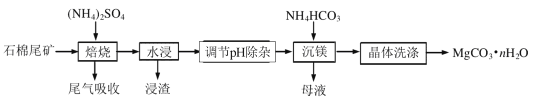
已知“焙烧”过程中的主反应为:
![]()
(1)写出焙烧产物NH3的电子式_____________________。
(2)为提高水浸速率,可采取的措施为_______________________(任写一条),“浸渣”的主要成分为__________________。
(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是______________,此时溶液中的c(Fe3+)=__________________(已知Ksp[Fe(OH)3]=4.0×10-38)。
(4) “沉镁”过程中反应的离子方程式为_______________________________________。“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是________________
【答案】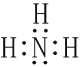 将焙烧渣粉碎或加热或搅拌SiO2Fe3+、Al3+4.0×10-11mol/LMg2++2HCO-+(n-1)H2O=MgCO3nH2O↓+CO2↑升温促进Mg2+部分水解或升温促进Mg2+水解
将焙烧渣粉碎或加热或搅拌SiO2Fe3+、Al3+4.0×10-11mol/LMg2++2HCO-+(n-1)H2O=MgCO3nH2O↓+CO2↑升温促进Mg2+部分水解或升温促进Mg2+水解
【解析】
以石棉尾矿(主要含有Mg3 ( Si2O5)(OH)4和少量的Fe2O3、Al2O3)为原料制备碳酸镁晶体(MgCO3nH2O)的工艺流程:加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,形成Mg2+、Fe3+、Al3+的溶液,SiO2不溶于水形成浸渣,加入NH3H2O将pH调至8.0左右,将Fe3+、Al3+以氢氧化物的形式过滤除去,向含有镁离子的滤液中加入碳酸氢铵发生反应:Mg2++2HCO3-+(n-1)H2O=MgCO3nH2O↓+CO2↑,洗涤晶体可得,据此分析解答。
(1)氨气为共价化合物,电子式为: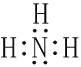 ;(2)将焙烧渣粉碎或加热或搅拌可以提高水浸速率,石棉尾矿加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,SiO2不溶于水形成浸渣;故答案为:将焙烧渣粉碎或加热或搅拌;SiO2;(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是Fe3+、Al3+;此时溶液中c(OH-)=10-9mol/L,Ksp[Fe(OH)3]= c(Fe3+) c3(OH-)= c(Fe3+)×(10-9mol/L)3 =4.0×10-38,则c(Fe3+)=4.0×10-11mol/L;(4)“沉镁”过程中反应的离子方程式为:Mg2++2HCO3-+(n-1)H2O=MgCO3nH2O↓+CO2↑;“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是升温促进Mg2+部分水解或升温促进Mg2+水解。
;(2)将焙烧渣粉碎或加热或搅拌可以提高水浸速率,石棉尾矿加入硫酸铵焙烧得到MgSO4、SiO2、Fe2O3、Al2O3,水浸,SiO2不溶于水形成浸渣;故答案为:将焙烧渣粉碎或加热或搅拌;SiO2;(3)“调节pH除杂”时,需将pH调至5.0,则除去的杂质离子是Fe3+、Al3+;此时溶液中c(OH-)=10-9mol/L,Ksp[Fe(OH)3]= c(Fe3+) c3(OH-)= c(Fe3+)×(10-9mol/L)3 =4.0×10-38,则c(Fe3+)=4.0×10-11mol/L;(4)“沉镁”过程中反应的离子方程式为:Mg2++2HCO3-+(n-1)H2O=MgCO3nH2O↓+CO2↑;“沉镁”时若温度超过60℃,将产生较多的碱式碳酸镁杂质,原因是升温促进Mg2+部分水解或升温促进Mg2+水解。


科目:高中化学 来源: 题型:
【题目】一定量的甲烷燃烧后得到的产物为CO、CO 2 和水蒸气,此混合气体质量为 49.6 g ,当其缓慢经过无水氯化钙(足量)时,氯化钙增重 25.2 g ,则原混合气体中CO 的质量为( )
A. 26.4 g B. 19.7 g C. 13.2 g D. 11.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、SO2是大气污染物但又有着重要用途。
I.已知:N2 (g) + O2(g) = 2NO (g) ΔH1= 180.5kJ·mol1
C(s) + O2(g) = CO2(g) ΔH2 = 393.5kJ·mol1
2C(s) + O2(g) =2CO(g) ΔH3 =221.0kJ·mol1
(1)某反应的平衡常数表达式为K=![]() , 此反应的热化学方程式为:_________
, 此反应的热化学方程式为:_________
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是_______(填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
II.(3)SO2可用于制Na2S2O3。为探究某浓度的Na2S2O3的化学性质,某同学设计如下实验流程:

用离子方程式表示Na2S2O3溶液具有碱性的原因___________。Na2S2O3与氯水反应的离子方程式是__________。
(4)含SO2的烟气可用Na2SO3溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为_________________________(任写一个)。离子交换膜______(填标号)为阴离子交换膜。

(5)2SO3(g)![]() 2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。
2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= _______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将___________(填“向正反应方向”或“向逆反应方向” “不”) 移动。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、R、M均为短周期元素,X、Y同周期,X、Y两种元素最高价氧化物对应水化物化学式分别为H2XO4和HYO4。R、M同主族,R与冷水即可反应,M与热水反应缓慢。下列关系正确的是 ( )。
A. 原子半径X>Y B. 氢化物稳定性H2X>HY
C. 原子核内质子数R<M D. 溶液碱性R(OH)2<M(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关水电离情况的说法正确的是
A. 25℃,pH=12 的烧碱溶液与纯碱溶液,水的电离程度相同
B. 其它条件不变,CH3COOH溶液在加水稀释过程中,c(OH-)/c(H+)一定变小
C. 其它条件不变,稀释氢氧化钠溶液,水的电离程度减小
D. 其它条件不变,温度升高,水的电离程度增大,Kw 增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol·L-1某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A. 该溶液的pH=4
B. 升高温度,溶液的pH增大
C. 此酸的电离常数约为1×10-7
D. 稀释HA溶液时,不是所有粒子浓度都一定会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】严重的雾霾天气的形成与汽车尾气排放有关。汽车尾气中常含有CO、NOx等气体,为减轻污染,一般汽车都加装了“催化净化器”,可将汽车尾气中的有毒气体转化为无污染的气体。某化学兴趣小组在实验室模拟汽车尾气处理,设计了下图所示装置(部分夹持装置已略去)。
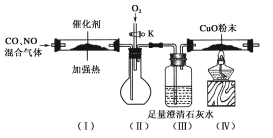
(1)装置(Ⅲ)的主要作用为________________________。
(2)停止加热,打开活塞K,放入适量氧气时,装置(Ⅱ)中可观察到的现象是___________________。
(3)该套装置中有不完善之处,还应在装置(Ⅳ)后补充____________。
(4)工业上常用纯碱液来吸收NOx,有关反应的化学方程式为2NO2+Na2CO3===NaNO2+NaNO3+CO2、NO2+NO+Na2CO3===2NaNO2+CO2。现有标准状况下a L NO2和b L NO的混合气体恰好被200 mL Na2CO3溶液完全吸收,则a、b应满足的关系为________。Na2CO3溶液的物质的量浓度为________mol·L-1(不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)X与L形成的常见阴离子的电子式为____________________。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程______,B的结构式_______________________。
(3)硒是人体必须的微量元素,与L同一主族,硒原子比L原子多两个电子层,则硒在周期表的位置为_______________,其最高价氧化物水化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com