
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
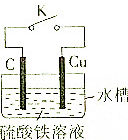 某同学为了探究原电池原理,设计如图所示装置:
某同学为了探究原电池原理,设计如图所示装置:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 甲基橙 | 甲基红 | 石蕊 | 酚酞 |
| 变色范围(pH) | 3.1-4.4 | 4.4-6.2 | 5.0-8.0 | 8.2-10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 21.02 | 20.32 | 20.28 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NaOH)=0时,c(Na+)>c(H+)>c(HC2O4- )>c(C2O42-)>c(OH-) | |
| B. | V(NaOH)=5 mL时,c(Na+)═c(C2O42-)+c(HC2O4- )+c(H2C2O4) | |
| C. | V(NaOH)=10 mL时,c(Na+)═c(HC2O4-)+c(C2O42-) | |
| D. | V(NaOH)>10 mL时,c(Na+)>c(C2O42-)>c(HC2O4- ) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
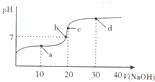 室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL0.1mol•L-1的醋酸溶液中不断滴人0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A. | a点时:c( CH3COOH)>c( Na+)>c( CH3COO-)>c( H+)>c( OH -) | |
| B. | b点时:c( Na+)=c( CH3COO-)>c(H+)=c( OH-) | |
| C. | c点时:c(H+)=c(CH3COOH)+c( OH-) | |
| D. | d点时:c(Na+)>c(CH3COO -)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | HA的物质的量 浓度(mol•L-1) | NaOH的物质的量 浓度(mol•L-1) | 混合后 溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子占核外电子总数的$\frac{3}{8}$ |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com