
| A. | 反应③为放热反应 | |
| B. | 当容器内湿埋不再变化时,上述各反应均达到化学平衡状态 | |
| C. | 当混合气体的密度不再变化时,上述各反应均达到化学平衡状态 | |
| D. | 若反应①的平衡常数为K1,反应②的平衡常数为K2,则反应③的平衡常数K3=2K1•K2 |
分析 A、①N2(g)+3H2(g)?2NH3(g)△H1=-92.2kJ•mol;②4NH3(g)?N4(g)+6H2(g)△H2=+1066.4kJ•mol;③2N2(g)?N4(g)△H3=2△H1+△H2=-2×92.2+1066.4=+882kJ•mol;
B、当容器内湿埋不再变化时,说明正逆反应速率相等;
C、向一恒容,参与反应的物质都是气体,所以气体的质量不变;
D、反应③2N2(g)?N4(g)是由反应①×2+②,所以若反应①的平衡常数为K1,反应②的平衡常数为K2,则反应③的平衡常数K3=K12•K2.
解答 解:A、①N2(g)+3H2(g)?2NH3(g)△H1=-92.2kJ•mol;②4NH3(g)?N4(g)+6H2(g)△H2=+1066.4kJ•mol;③2N2(g)?N4(g)△H3=2△H1+△H2=-2×92.2+1066.4=+882kJ•mol,所以正反应是吸热反应,故A错误;
B、当容器内湿埋不再变化时,说明正逆反应速率相等,反应达平衡状态,故B正确;
C、向一恒容,参与反应的物质都是气体,所以气体的质量不变,所以密度始终不变,故C错误;
D、反应③2N2(g)?N4(g)是由反应①×2+②,所以若反应①的平衡常数为K1,反应②的平衡常数为K2,则反应③的平衡常数K3=K12•K2,故D错误;
故选B.
点评 本题考查化学反应热、化学平衡状态的判断、化学平衡常数及其计算等,难度中等,注意基础知识理解掌握.


科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | / | 0.02 |
| 容器Ⅱ | 300 | 0.6 | 0.2 | / | / |
| 容器Ⅲ | 240 | 0.3 | 0.1 | / | 0.01 |
| A. | 该反应的正反应吸热 | |
| B. | 到达平衡时,容器Ⅰ中SO2的转化率比容器Ⅱ的大 | |
| C. | 240℃时,该反应的平衡常数为1.08×104 | |
| D. | 到达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 对于反应:H2(g)+Cl2(g)=2HCl (g)△H=-a kJ/mol,表明破坏旧化学键吸收的能量比形成新化学键释放的能量多 | |
| B. | 2MnO(s)+O2(g)═2MnO2(s),该反应在低温下能自发进行,则其△H<0 | |
| C. | 用干燥的pH试纸测得某氯水的pH=3.1 | |
| D. | 航行在大海中的轮船水面上的部分比水面下的部分腐蚀得慢,因为水下易发生电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
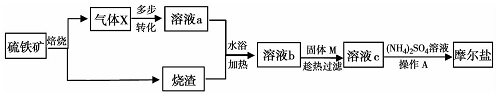
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
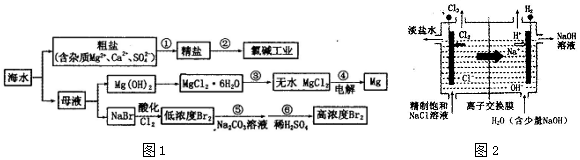
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X的简单阴离子与Y的简单阳离子半径:X<Y | |
| B. | X分别与Z、W、Q形成的最简单化合物的稳定性:Z<W<Q | |
| C. | ZQ3分子中的所有原子最外层均满足8电子结构 | |
| D. | W、Q形成的含氧酸均为强酸. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打可以与胃酸反应,可用小苏打治疗胃酸过多 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果发生了加成反应 | |
| C. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 加人足量氢氧化钠溶液共热.能区别地沟油(加工过的餐饮废弃油)与矿物油(汽油、煤油、柴油等) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+ )>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol/L pH为3的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| C. | 硫酸氢铵溶液中滴加氢氧化钠至溶液恰好呈中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH- )=c(H+) | |
| D. | c(NH4+ )相等的(NH4)2SO4溶液、(NH4)2Fe (SO4)2溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2Fe (SO4)2]<c(NH4Cl) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com