
已知:H(g) + H(g) = H2(g) ΔH=-435.7kJ/mol,此热化学方程式包含的意义是
A.氢原子的能量比氢分子的能量低
B.两个氢原子结合成一个氢分子时放出435.7kJ能量
C. 1mol氢分子分解成2mol氢原子要吸收435.7kJ能量
D. 2mol氢原子结合1mol氢分子成要吸收435.7kJ能量
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
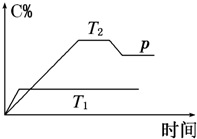 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后向容器加压的变化情况,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
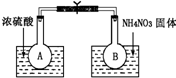 已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com