
| A. | NaHCO3溶液中加入盐酸:CO32-+2H+═CO2↑+H2O | |
| B. | 紫色石蕊试液中滴入氢硫酸变红的原因是:H2S?2H++S2- | |
| C. | 等物质的量的MgCl2、Ba(OH)2和 HC1溶液混合:Mg2++2OH-═Mg(OH)2↓ | |
| D. | 铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-═PbO2+4H++SO42- |
分析 A.碳酸氢根离子为多元弱酸的酸式根离子,不能拆;
B.硫化氢为多元弱酸,分步电离,以第一步为主;
C.氢离子先与氢氧根离子发生酸碱中和,剩余的氢氧根离子再与镁离子反应生成氢氧化镁沉淀;
D.铅酸蓄电池充电时的正极发生氧化反应,硫酸铅失去电子生成氧化铅.
解答 解:A.NaHCO3溶液中加入盐酸,离子方程式:HCO3-+H+═CO2↑+H2O,故A错误;
B.紫色石蕊试液中滴入氢硫酸变红的原因是,离子方程式:H2S?H++HS-,故B错误;
C.反应生成氢氧化镁、水,离子方程式为2H++Mg2++4OH-═Mg(OH)2↓+2H2O,故C错误;
D.铅酸蓄电池充电时的正极反应,离子方程式:PbSO4+2H2O-2e-═PbO2+4H++SO42-,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意离子反应遵循客观事实、遵循原子个数、电荷数守恒规律,注意铅蓄电池工作原理,题目难度不大.


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应开始前,检查装置的气密性 | |
| B. | 加入过量稀硫酸,以确保镁带完全反应 | |
| C. | 反应停止后,立即调压并记录读数 | |
| D. | 常温下1mol氢气的体积为$\frac{V({H}_{2})}{m(Mg)}$×M(Mg) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤⑥ | B. | ④⑤⑥ | C. | ②④⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
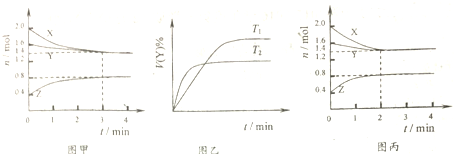
| A. | T1℃时,容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g),且正反应放热 | |
| B. | T1℃时,反应进行的前3min内,用X表示的反应速率v(X)=0.2mol•(L•min)-1 | |
| C. | T1℃时,3min达到平衡后,向容器中再加入2.0mol X、1.6mol Y、0.4mol Z,反应达到新平衡时:0.7mol•L-1<c(Y)<1.4mol•L-1 | |
| D. | 若改变反应条件,使反应进程如图丙所示,则改变的条件是使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
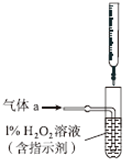 硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
硫酸工业产生的废气(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境.某化学兴趣小组对废气的组成进行探究,请回答下列问题:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物理性质 | 制备原理 | 化学性质 |
| 黄色油状液体 熔点为-40℃,沸点为71℃ 不溶于冷水,易溶于有机溶剂 密度为1.65g/mL | Cl2与NH4Cl水溶液在低温下反应 | 95℃爆炸,热水中发生水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
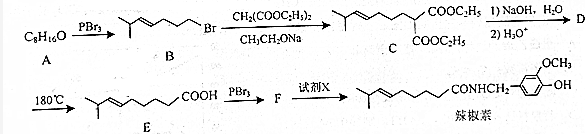
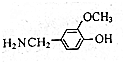 ,由B→C的反应类型是取代,
,由B→C的反应类型是取代,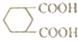 的合成路线流程图(无机试剂任用,上述流程中出现的试剂可用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$^CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任用,上述流程中出现的试剂可用).合成路线流程图示例如下:CH2=CH2$\stackrel{HBr}{→}$^CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与H2SO4溶液反应 | B. | 氢氧化钡溶液与HNO3溶液反应 | ||
| C. | KOH溶液和醋酸溶液反应 | D. | 氢氧化钠溶液与NaHCO3溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com