
| t/s | 0 | 2 | 4 | 6 | 8 |
| n£ØCl2£©/mol | 0 | 0.030 | 0.039 | 0.040 | 0.040 |
| A£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±c£ØCl2£©=0.022mol•L-1£¬Ōņ·“Ó¦µÄ”÷H£¼0 | |
| B£® | ·“Ó¦ŌŚĒ°2sµÄĘ½¾łĖŁĀŹv£ØCO£©=0.015mol•L-1•S-1 | |
| C£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĘšŹ¼ĻņČŻĘ÷ÖŠ³äČė0.12molCOCl2ŗĶ0.060molCl2”¢0.060 molCO£¬·“Ó¦“ļµ½Ę½ŗāĒ°µÄĖŁĀŹ£ŗvÕż£¼vÄę | |
| D£® | ±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĘšŹ¼ĻņČŻĘ÷ÖŠ³äČė0.10molCl2ŗĶ0.08molCO£¬“ļµ½Ę½ŗāŹ±£¬Cl2µÄ×Ŗ»ÆŠ”ÓŚ60% |
·ÖĪö A£®ÓɱķÖŠŹż¾ŻæÉÖŖ£¬Ę½ŗāŹ±n£ØCl2£©=0.04mol£¬±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±c£ØCl2£©=0.022 mol/L£¬Ōņn”ä£ØCl2£©=0.044mol£¾0.04mol£¬æÉÖŖĘ½ŗāÕżĻņŅĘ¶Æ£¬ÉżøßĪĀ¶ČĘ½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£»
B£®ÓɱķÖŠŹż¾ŻæÉÖŖ2sÄŚ£¬”÷n£ØCl2£©=0.03mol£¬øł¾Żv=$\frac{\frac{”÷n}{V}}{”÷t}$¼ĘĖćv£ØCl2£©£»
C£®¼ĘĖćĘ½ŗāŹ±ø÷×é·ÖĪļÖŹµÄĮæÅØ¶Č£¬øł¾ŻK=$\frac{c£ØC{l}_{2}£©”Įc£ØCO£©}{c£ØCOC{l}_{2}£©}$¼ĘĖćĘ½ŗā³£Źż£¬ŌŁ¼ĘĖćÅضČÉĢ£ØQc£©£¬ČōK£¾Qc£¬·“Ó¦ĻņÕż·“Ó¦·½Ļņ½ųŠŠ£¬ČōK£¼Qc£¬·“Ó¦ĻņÄę·“Ó¦·½Ļņ½ųŠŠ£¬ČōK=Qc£¬“¦ÓŚĘ½ŗāדĢ¬£»
D£®ŌĘ½ŗāµČŠ§ĪŖŌŚŌĘ½ŗāµÄ»ł“”ÉĻ¼ÓČė0.08mol CO£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗāŹ±ĀČĘųµÄĪļÖŹµÄĮæŠ”ÓŚ0.4mol£¬Ōņ²Ī¼Ó·“Ó¦µÄCl2µÄĪļÖŹµÄĮæŠ”ÓŚ0.6mol£®
½ā“š ½ā£ŗÓɱķÖŠŹż¾ŻæÉÖŖ£¬Ę½ŗāŹ±n£ØCl2£©=0.04mol£¬±£³ÖĘäĖūĢõ¼ž²»±ä£¬ÉżøßĪĀ¶Č£¬Ę½ŗāŹ±c£ØCl2£©=0.022 mol/L£¬Ōņn”ä£ØCl2£©=0.022 mol/L”Į2L=0.044mol£¾0.04mol£¬æÉÖŖĘ½ŗāÕżĻņŅĘ¶Æ£¬ÉżøßĪĀ¶ČĘ½ŗāĻņĪüČČ·“Ó¦·½ĻņŅĘ¶Æ£¬Õż·“Ó¦ĪŖĪüČČ·“Ó¦£¬¼“”÷H£¾O£¬¹ŹA“ķĪó£»
B£®ÓɱķÖŠŹż¾ŻæÉÖŖ2sÄŚ£¬”÷n£ØCl2£©=0.03mol£¬Ōņv£ØCl2£©=$\frac{\frac{0.03mol}{2L}}{2s}$=0.0075mol/£ØL•s£©£¬¹ŹB“ķĪó£»
C£®6s“¦ÓŚĘ½ŗāדĢ¬£¬Ōņ£ŗ
COCl2£Øg£©?Cl2£Øg£©+CO£Øg£©
æŖŹ¼£Ømol/L£©£ŗ0.05 0 0
±ä»Æ£Ømol/L£©£ŗ0.02 0.02 0.02
Ę½ŗā£Ømol/L£©£ŗ0.03 0.02 0.02
ĖłŅŌĘ½ŗā³£ŹżK=$\frac{0.02*0.02}{0.03}$=0.013£®
ĘšŹ¼ĻņČŻĘ÷ÖŠ³äČė0.12molCOCl2ŗĶ0.06molCl2”¢0.06 molCO£¬ĘšŹ¼Ź±COCl2µÄÅضČĪŖ0.06mol/L”¢Cl2µÄÅضČĪŖ0.03mol/L”¢COµÄÅضČĪŖ0.03mol/L£¬ÅضČÉĢQc=$\frac{0.03”Į0.03}{0.06}$=0.015£¾K=0.013£¬ĖµĆ÷Ę½ŗāĻņÄę·“Ó¦·½ĻņŅĘ¶Æ£¬·“Ó¦“ļĘ½ŗāĒ°v£ØÕż£©£¼v£ØÄę£©£¬¹ŹC“ķĪó£»
D£®ŌĘ½ŗāµČŠ§ĪŖŌŚŌĘ½ŗāµÄ»ł“”ÉĻ¼ÓČė0.08mol CO£¬Ę½ŗāÄęĻņŅĘ¶Æ£¬Ę½ŗāŹ±ĀČĘųµÄĪļÖŹµÄĮæŠ”ÓŚ0.4mol£¬Ōņ²Ī¼Ó·“Ó¦µÄCl2µÄĪļÖŹµÄĮæŠ”ÓŚ0.6mol£¬Ōņ“ļµ½Ę½ŗāŹ±Cl2µÄ×Ŗ»ÆŠ”ÓŚ60%£¬¹ŹDÕżČ·£®
¹ŹŃ”D£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗā¼ĘĖć”¢Ę½ŗā³£ŹżÓ¦ÓĆ”¢Ę½ŗāŅĘ¶Æ”¢µČŠ§Ę½ŗāµČ£¬ÄѶČÖŠµČ£¬×¢ŅāDÖŠŹ¹ÓƵȊ§Ę½ŗāĖ¼Ļė·ÖĪö£¬Ź¹ĪŹĢā¼ņµ„»Æ£¬Ņ²æÉŅŌøł¾ŻĘ½ŗā³£Źż¼ĘĖć£¬µ«±Č½ĻĀé·³£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
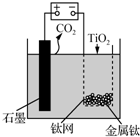 ÓĆČēĶ¼ĖłŹ¾×°ÖĆ£ØČŪČŚCaF2-CaO×÷µē½āÖŹ£©»ńµĆ½šŹōøĘ£¬²¢ÓĆøĘ»¹ŌTiO2Öʱø½šŹōīŃ£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©
ÓĆČēĶ¼ĖłŹ¾×°ÖĆ£ØČŪČŚCaF2-CaO×÷µē½āÖŹ£©»ńµĆ½šŹōøĘ£¬²¢ÓĆøĘ»¹ŌTiO2Öʱø½šŹōīŃ£®ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø””””£©| A£® | µē½ā¹ż³ĢÖŠ£¬Ca2+ĻņŃō¼«ŅĘ¶Æ | |
| B£® | Ńō¼«µÄµē¼«·“Ó¦Ź½ĪŖ£ŗC+2O2--4e-ØTCO2”ü | |
| C£® | ŌŚÖʱø½šŹōīŃĒ°ŗó£¬ÕūĢ××°ÖĆÖŠCaOµÄ×ÜĮæ¼õÉŁ | |
| D£® | ČōÓĆĒ¦Šīµē³Ų×÷øĆ×°ÖĆµÄ¹©µēµēŌ“£¬”°+”±½ÓĻßÖłŹĒPbµē¼« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¼ÓĖ® | B£® | ¼ÓÉŁĮæ±ł“×Ėį | C£® | ½µµĶĪĀ¶Č | D£® | ¼ÓÉŁĮæÉÕ¼īČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µēĄė³Ģ¶Č | B£® | “×ĖįµÄµēĄė³£Źż | ||
| C£® | ÖŠŗĶŹ±ĖłŠčNaOHµÄĪļÖŹµÄĮæ | D£® | CH3COOHµÄĪļÖŹµÄĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | V1£¾V2=V3 | B£® | V1£¾V2£¾V3 | C£® | V1=V2=V3 | D£® | V1=V2£¼V3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Na2SO3ČÜŅŗÖŠ¼ÓČėĻ”ĻõĖį£ŗSO32-+2H+ØTSO2”ü+H2O | |
| B£® | NH4HSO3ČÜŅŗÓėÉŁĮæµÄNaOHČÜŅŗ»ģŗĻ¼ÓČČ£ŗNH4++OH-$\frac{\underline{\;\;”÷\;\;}}{\;}$NH3”ü+2H2O | |
| C£® | FeBr2ČÜŅŗÖŠĶØČė×ćĮæµÄCl2£ŗ4Fe2++4Br-+3Cl2ØT4Fe3++2Br2+6Cl- | |
| D£® | ĻņĢ¼ĖįĒāøĘČÜŅŗ¼ÓČėÉŁĮæĒāŃõ»Æ¼ŲČÜŅŗ£ŗCa2++2HCO3-+2OH-ØTCaCO3”ż+2H2O+CO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā




| A£® | ¢ą | B£® | ³ż¢Ž¢ßĶā | C£® | ³ż¢Ū¢Ž¢ß¢įĶā | D£® | ¢Ł¢Ü¢ą¢į¢ā |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com