
【题目】根据所学知识完成题目:
(1)用单线桥表示下列反应中电子转移方向和数目:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O_____
(2)钙元素是人体必需的常量元素,所有的细胞都需要钙元素.测定人体血液中钙元素的含量常用到如下两个反应:①CaC2O4+H2SO4=H2C204+CaSO4②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,上述反应②的还原剂是___;若收集到44.8mL(标准状况)的CO2时,消耗氧化剂___mol,有__mol电子发生转移,相当于测出含钙元素的质量是__g。
(3)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。写出碱性条件下制高铁酸钾的离子反应方程式:_____。
【答案】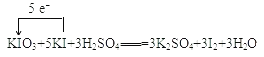 H2C2O4 4×10-4 2×10-3 0.04 2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42- + 3Cl- + 5H2O
H2C2O4 4×10-4 2×10-3 0.04 2Fe(OH)3 + 3ClO- + 4OH- = 2FeO42- + 3Cl- + 5H2O
【解析】
(1) KIO3中碘化合价降低,KI中碘化合价升高,再分析转移电子数目。
(2)锰化合价降低,草酸中碳元素化合价升高,因此上述反应②的还原剂是草酸;若收集到44.8mL(标准状况)即物质的量为0.002mol的CO2时,根据方程式关系得到消耗氧化剂![]() ,根据方程式2mol高锰酸钾转移了10mol电子,有
,根据方程式2mol高锰酸钾转移了10mol电子,有![]() 电子发生转移,根据碳守恒得出草酸的物质的量为0.001mol,钙元素的物质的量等于草酸的物质的量,即测出含钙元素的质量。
电子发生转移,根据碳守恒得出草酸的物质的量为0.001mol,钙元素的物质的量等于草酸的物质的量,即测出含钙元素的质量。
(3)根据化合价分析,高铁酸钾由氢氧化铁升高得到,则次氯酸化合价降低得到氯离子,因此可以书写出碱性条件下制高铁酸钾的离子反应方程式。
(1) KIO3中碘化合价降低,KI中碘化合价升高,其电子转移表示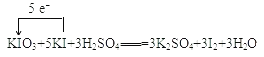 ,故答案为:
,故答案为: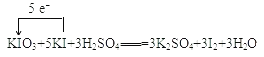 。
。
(2)②2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H2O,锰化合价降低,草酸中碳元素化合价升高,因此上述反应②的还原剂是草酸;若收集到44.8mL(标准状况)即物质的量为0.002mol的CO2时,根据方程式关系得到消耗氧化剂![]() ,根据方程式2mol高锰酸钾转移了10mol电子,若收集到44.8mL(标准状况)即物质的量为0.002mol的CO2时,有
,根据方程式2mol高锰酸钾转移了10mol电子,若收集到44.8mL(标准状况)即物质的量为0.002mol的CO2时,有![]() 电子发生转移,根据碳守恒得出草酸的物质的量为0.001mol,钙元素的物质的量等于草酸的物质的量,即测出含钙元素的质量是
电子发生转移,根据碳守恒得出草酸的物质的量为0.001mol,钙元素的物质的量等于草酸的物质的量,即测出含钙元素的质量是![]() ,故答案为:H2C2O4;4×10-4;2×10-3;0.04。
,故答案为:H2C2O4;4×10-4;2×10-3;0.04。
(3)根据化合价分析,高铁酸钾由氢氧化铁升高得到,则次氯酸化合价降低得到氯离子,因此碱性条件下制高铁酸钾的离子反应方程式2Fe(OH)3 + 3ClO + 4OH = 2FeO42 + 3Cl + 5H2O,故答案为:2Fe(OH)3 + 3ClO + 4OH = 2FeO42 + 3Cl + 5H2O。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】镁与稀硝酸的反应为:Mg+ HNO3(稀)—— Mg(NO3)2+ NO↑+ H2O
(1)配平上述化学方程式并用“双线桥法”表示该反应中电子转移的方向和数目。________
(2)该反应中,还原产物是_________,HNO3表现了______________(选填“还原性”、“氧化性”、“酸性”、“碱性”)。
(3)若反应过程中转移的电子为0.6 mol,则被还原的硝酸物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极 a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8)。下列说法错误的是( )
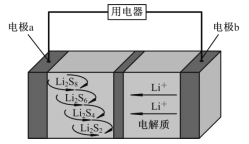
A. 电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4
B. 电池工作时,外电路中流过 0.02 mol 电子,负极材料减重 0.14 g
C. 石墨烯的作用主要是提高电极a的导电性
D. 电池充电时间越长,电池中Li2S2的量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是l mol金属镁和卤素反应的△H(单位:kJ· mol-1)示意图,反应物和生成物均为常温时的稳定状态,下列选项中不正确的是
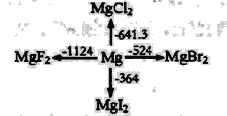
A.由图可知,MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ· mol-1
B.MgI2与Br2反应的△H<0
C.电解MgBr2制Mg是吸热反应
D.化合物的热稳定性顺序:MgI2>MgBr2>MgCl2>MgF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个2 L恒容的容器中,分别发生反应A(g)+3B(g)![]() 2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是()
2C(g),5min后各容器反应达平衡状态,其中甲容器中A的物质的量为0.4 mol。下列说法正确的是()
反应前各物质的物质的量/mol
A | B | C | |
甲 | 1 | 3 | 0 |
乙 | 0 | 0 | 2 |
丙 | 1.5 | 4.5 | 1 |
A.乙中5min内C的反应速率为0.16mol-1·min-1
B.达到平衡时,丙中A的浓度是甲中的2倍
C.丙中反应的平衡常数大于甲中反应的平衡常数
D.达到平衡时,甲、乙两容器中C的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。
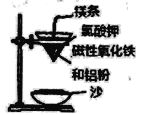
(l)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图)进行铝热反应,现象很壮观。使用镁条和氯酸钾的目的是___________。
(2)某同学取反应后的“铁块”和稀硝酸反应制备Fe(NO3)3溶液,其离子方程式为__________,溶液中可能含有Fe2+,其原因是___________;
(3)可通过KClO溶液与Fe(NO3)3溶液的反应制备高铁酸钾(K2FeO4),如图所示是实验室模拟工业制备KClO溶液装置。已知氯气和热碱溶液反应生成氯化钾和氯酸钾和水

①盛装饱和食盐水的B装置作用为______________;
②反应时需将C装置置于冷水浴中,其原因为___________;
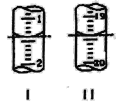
(4)工业上用“间接碘量法”测定高铁酸钾的纯度:用碱性KI溶液溶解1.00g K2FeO4样品,调节pH使高铁酸根全部被还原成亚铁离子,再调节pH为3~4,用1.0 mol/L的Na2S2O3标准溶液作为滴定剂进行滴定(2Na2S2O3+I2=Na2S4O6+2NaI),淀粉作指示剂,装有Na2S2O3标准溶液的滴定管起始和终点读数如图所示:
①终点II的读数为_______mL。
②原样品中高铁酸钾的质量分数为_________。[M(K2FeO4)=198g/mol]
③若在配制Na2S2O3标准溶液的过程中定容时俯视刻度线,则导致所测高铁酸钾的质量分数_______(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,科学家已经研制出世界上最薄的材料——碳膜片,其厚度只有一根头发的二十万分之一。如图所示,这种碳膜片形状如蜂巢,是由碳原子构成的六边形单元向外延展而成,下列有关碳膜片的说法中,正确的是( )

A. 碳膜片属于一种新型的化合物
B. 碳膜片与石墨的结构相同
C. 碳膜片与C60互为同素异形体
D. 碳膜片在氧气中完全燃烧的产物和碳在氧气中完全燃烧的产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用草酸泥渣(含73.75%PbC2O4、24.24%PbSO4)制备PbCrO4的工艺流程如下:
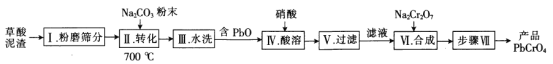
回答下列问题:
已知:①PbC2O4完全分解的化学方程式为![]() 。
。
②PbCrO4难溶于水。
(1)泥渣“粉磨筛分”的目的是___________________________________。
(2)用Na2CO3将PbSO4转化为PbCO3的目的是_______________________;若在水溶液中进行![]() ,该反应的平衡常数K=______________________________________[已知KSP(PbCO3)=6.4×10-14,KSP(PbSO4)=1.6×10-8]。
,该反应的平衡常数K=______________________________________[已知KSP(PbCO3)=6.4×10-14,KSP(PbSO4)=1.6×10-8]。
(3)步骤Ⅵ“合成”时发生反应的化学方程式为____________________。
(4)“步骤Ⅶ”包含的实验操作有___________________________________及干燥。
(5)某工厂用10t该草酸泥渣制备PbCrO4,最终得到9.69t产品,Pb元素的转化率为_______(精确到小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
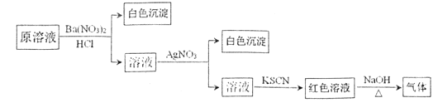
A.原溶液中一定含有![]() 离子B.原溶液中一定含有
离子B.原溶液中一定含有![]()
C.原溶液中一定含有Cl-离子D.原溶液中一定含有Fe3+离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com