
| 组别 | 10%硫酸的体积(mL) | 温度/℃ | 其他物质 |
| ① | 2 mL | 20 | |
| ② | 2 mL | 20 | 10滴饱和MnSO4溶液 |
| ③ | 2 mL | 30 | |
| ④ | 1 mL | 20 | 1 mL蒸馏水 |


科目:高中化学 来源:不详 题型:实验题
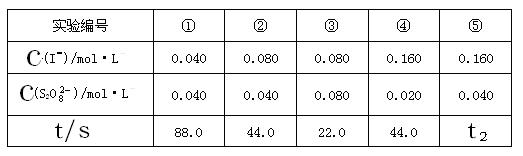
| A.<22.0s | B.22.0~44.0s | C.>44.0s | D.数据不足,无法判断 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲、乙、丙、丁 | B.乙、甲、丙、丁 |
| C.乙、甲、丁、丙 | D.丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.溴水中有下列平衡   ,当加入 ,当加入 溶液后,溶液颜色变浅 溶液后,溶液颜色变浅 |
B.对   平衡体系,增大平衡体系的压强可使颜色变深 平衡体系,增大平衡体系的压强可使颜色变深 |
C.反应   (正反应放热),升高温度可使平衡向逆反应方向移动 (正反应放热),升高温度可使平衡向逆反应方向移动 |
| D.打开啤酒瓶盖后产生大量的气泡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.V(NH3) =" 0.1" mol/(L·min) | B.V (H2) =" 0.6" mol/(L·min) |
| C.V (N2) =" 0.3" mol/(L·min) | D.V (H2) =" 0.3" mol/(L·min) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入一定量的CaCl2 |
| B.加入一定量的CaCO3 |
| C.加入15mL0.5mol/L的盐酸 |
| D.加入5mLH2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2 NH3 (g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中正确的是
2 NH3 (g) ΔH<0,达平衡后,将气体混合物的温度降低,下列叙述中正确的是| A.正反应速率增大,逆反应速率减小,平衡一定向正反应方向移动 |
| B.正反应速率减小,逆反应速率减小,平衡一定向逆反应方向移动 |
| C.若同时扩大容器的体积,则正逆反应速率一定都减小,平衡向逆反应方向移动 |
| D.若温度降低至氨气液化,则平衡一定向正反应方向移动,氨气产率提高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.活化分子相互碰撞即可发生化学反应 |
| B.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率 |
| C.某一反应的活化分子百分率是个定值 |
| D.浓度增大使得反应物分子中的活化分子百分率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com