
【题目】某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去.为研究其组成,某小组同学进行了如下实验. 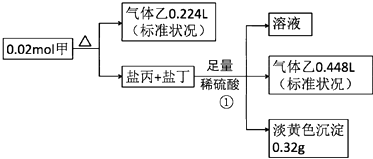
又知,甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定
(1)甲中所含阳离子的结构示意图 , 甲的化学式
(2)写出 ①中产生黄色沉淀的反应的离子反应方程式
(3)乙能使品红溶液褪色的原因是
(4)甲的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,试写出该反应的化学反应方程式
(5)下列物质中可能在溶液中与甲反应的是
A.NaI
B.Cl2
C.AgNO3
D.NaOH.
【答案】
(1) ;Na2S2O4
;Na2S2O4
(2)S2O32﹣+2H+=S↓+SO2↑+H2O
(3)能与品红结合生成不稳定的无色化合物
(4)Na2S2O4+O2+H2O=NaHSO3+NaHSO4
(5)BC
【解析】解:甲的焰色为黄色,含有Na元素,盐丙和丁的组成元素和甲相同,加入足量硫酸反应生成的乙能使品红溶液褪色,则乙为SO2 , 生成的淡黄色沉淀为S,丙、丁中其中一种为Na2S2O3 , 发生反应:Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O,反应①生成的二氧化硫为 ![]() =0.02mol,硫为0.32g即0.01mol,而Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O中生成的S、SO2均为0.01mol,故丙、丁中其中一种为Na2SO3 , 发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,该反应生成SO2为0.02mol﹣0.01mol=0.01mol,结合方程式可知,Na2S2O3为0.01mol,Na2SO3为0.01mol,甲分解得到二氧化硫为
=0.02mol,硫为0.32g即0.01mol,而Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O中生成的S、SO2均为0.01mol,故丙、丁中其中一种为Na2SO3 , 发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,该反应生成SO2为0.02mol﹣0.01mol=0.01mol,结合方程式可知,Na2S2O3为0.01mol,Na2SO3为0.01mol,甲分解得到二氧化硫为 ![]() =0.01mol,根据原子守恒可知,0.02mol甲中含有:Na原子为0.01mol×2+0.01mol×2=0.04mol,S原子为0.01mol+0.01mol×2+0.01mol=0.04mol,O原子为(0.01mol+0.01mol)×3+0.01mol×2=0.08mol,则1mol甲含有2molNa原子、2molS原子、4molO原子,故甲的化学式为Na2S2O4 , (1)甲为Na2S2O4 , 甲中所含阳离子的结构示意图为:
=0.01mol,根据原子守恒可知,0.02mol甲中含有:Na原子为0.01mol×2+0.01mol×2=0.04mol,S原子为0.01mol+0.01mol×2+0.01mol=0.04mol,O原子为(0.01mol+0.01mol)×3+0.01mol×2=0.08mol,则1mol甲含有2molNa原子、2molS原子、4molO原子,故甲的化学式为Na2S2O4 , (1)甲为Na2S2O4 , 甲中所含阳离子的结构示意图为:  , 所以答案是:
, 所以答案是:  ;Na2S2O4;(2)①中产生黄色沉淀的反应的离子反应方程式:S2O32﹣+2H+=S↓+SO2↑+H2O,
;Na2S2O4;(2)①中产生黄色沉淀的反应的离子反应方程式:S2O32﹣+2H+=S↓+SO2↑+H2O,
所以答案是:S2O32﹣+2H+=S↓+SO2↑+H2O;(3)乙为二氧化硫,能与品红结合生成不稳定的无色化合物,使品红溶液褪色,
所以答案是:能与品红结合生成不稳定的无色化合物;(4)Na2S2O4的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,硫元素化合价升高,反应生成NaHSO3、NaHSO4 , 该反应的化学反应方程式:Na2S2O4+O2+H2O=NaHSO3+NaHSO4 ,
所以答案是:Na2S2O4+O2+H2O=NaHSO3+NaHSO4;(5)甲具有还原性,氯气具有氧化性,硝酸银溶液显酸性,具有氧化性,二者可能与甲反应,
故选:BC.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.1mol Na与足量O2反应,生成Na2O和Na2O2 的混合物,钠失去电子数为NA
B.常温常压下,32gO2 和O3 的混合气体所含原子数为2NA
C.22.4LCl2含有的原子数为2NA
D.标准状况下,1molFe与22.4LCl2充分反应,转移电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3在工业生产上有重要的应用
(1)写出用浓氨水检验氯气管道泄漏的化学反应方程式
(2)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学帮助水质检测站配制480mL0.5molL﹣1 NaOH溶液以备使用. 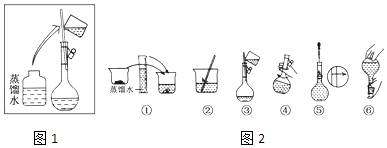
(1)该同学应选择mL的容量瓶.使用容量瓶前必须进行的一步操作是
(2)其操作步骤如下图所示,则如图操作应在下图中的(填选项字母)之间.
A.②与③
B.①与②
C.④与⑤
(3)该同学应称取NaOH固体g
(4)下列操作对所配溶液的浓度大小有何影响?用“偏高”“偏低”或“无影响”填空: ①定容时俯视刻度线:;
②摇匀后,液面低于刻度线,没有再加水: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,一般不能用于判断金属性强弱的是( )
A.金属间发生的置换反应
B.1mol金属单质在反应中失去电子的多少
C.金属元素的最高价氧化物对应水化物的碱性强弱
D.金属元素的单质与水或酸置换出氢的难易程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素的性质随着原子序数的递增呈现周期性变化的原因是
A. 元素原子的核外电子排布呈周期性变化
B. 元素原子的最外层电子排布呈周期性变化
C. 元素的化合价呈周期性变化
D. 元素原子半径呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B与稀硫酸组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为( )
A. A>B>CB. A>C>BC. C>B>AD. B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示的装置蒸馏海水,下列说法正确的是( )
A.实验时冷却水应从a进入,从b流出
B.蒸馏烧瓶中要加入碎瓷片,目的是防止暴沸
C.锥形瓶中能收集到高浓度的氯化钠溶液
D.该装置可用于分离海水中的NaCl和MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com