
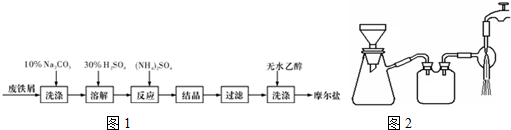
分析 制取摩尔盐晶体流程为:先利用碳酸钠溶液呈碱性,除去铁表面的油污,然后加稀硫酸溶解,铁与稀硫酸反应生成亚铁离子,加入硫酸铵发生(NH4)2 SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓,结晶过滤,摩尔盐易溶于水,难溶于有机溶剂,用酒精洗涤摩尔盐,得到摩尔盐晶体.
(1)Na2CO3溶液中CO32-水解使Na2CO3溶液呈碱性,油脂在碱性溶液中水解,利用碳酸钠溶液呈碱性,除去铁表面的油污;
(2)当有晶膜出现时,则停止加热,防止摩尔盐失水;
(3)过滤适用于不溶于水的固体和液体;减压的操作优点是:可加快过滤速度,并能得到较干燥的沉淀;
(4)根据“相似相溶原理”可知摩尔盐易溶于水,难溶于有机溶剂.
解答 解:制取摩尔盐晶体流程为:先利用碳酸钠溶液呈碱性,除去铁表面的油污,然后加稀硫酸溶解,铁与稀硫酸反应生成亚铁离子,加入硫酸铵发生(NH4)2 SO4+FeSO4+6H2O=(NH4)2SO4•FeSO4•6H2O↓,结晶过滤,摩尔盐易溶于水,难溶于有机溶剂,用酒精洗涤摩尔盐,得到摩尔盐晶体.
(1)Na2CO3溶液中CO32-水解CO32-+H2O?HCO3-+OH-,使Na2CO3溶液呈碱性,油脂在碱性溶液中水解生成溶于水的物质易于洗去,步骤1中加入10%Na2CO3溶液的主要作用是除去铁屑表面的油污,
故答案为:利用碳酸钠溶液呈碱性,除去铁表面的油污;
(2)浓缩结晶摩尔盐时要用小火加热,加热浓缩初期可轻微搅拌,但注意观察晶膜,若有晶膜出现,则停止加热,防止摩尔盐失水;更不能蒸发至干,蒸干时溶液中的杂质离子会被带入晶体中,晶体可能会受热分解或被氧化,
故答案为:B;
(3)减压过滤,利用大气压强原理,用减小压力的方法加快过滤的速率,并能得到较干燥的沉淀,所以过滤速度较快的原因是:(该装置)减小了锥形瓶内的压强,
故答案为:(该装置)减小了锥形瓶内的压强;
(4)摩尔盐易溶于水,不能用蒸馏水洗涤,但摩尔盐属于无机物难溶于有机物,可用乙醇进行洗涤,洗去晶体表面的液体杂质,
故答案为:减少晶体溶解损失;容易干燥.
点评 本题以莫尔盐的制备为载体,考查盐类水解、物质分离提纯等有关实验操作以及在新情境下综合运用知识解决问题的能力.题目难度中等,注意基础知识的全面掌握.


科目:高中化学 来源: 题型:填空题
 铁在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.
铁在生产和生活中有着广泛的应用.某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S溶液中通入适量H2S:S2-+H2S═2HS- | |
| B. | 氧化铁溶于氢碘酸:Fe2O3+6H-═2Fe3++3H2O | |
| C. | 过量铁粉加入稀HNO3溶液中:3Fe+8H++2NO${\;}_{3}^{-}$═3Fe2++2NO↑+4H2O | |
| D. | NaHSO3溶液显酸性的原因:HSO${\;}_{3}^{-}$+H2O?SO${\;}_{3}^{2-}$+H3O- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.
某化学兴趣小组的同学为探究Fe(NO3)2等硝酸盐热分解产物和产物的性质,他们开展了如下探究性学习.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com