
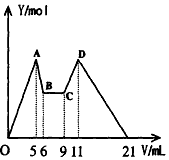
分析 由图可知,A→B(1 mL)、C→D(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl,得关系式NaOH~Al(OH)3~AlO2-~H+,根据关系式可以推出:c(NaOH):c(HCl)=2:1;
O-B(6mL)是镁离子、铝离子和NaOH反应过程,该溶液中加入的体积为NaOH体积;9-21mL为偏铝酸根离子、氢氧化镁、氢氧化铝和HCl的反应,为HCl体积;
B-C体积为NaOH、HCl混合体积,因为c(NaOH):c(HCl)=2:1,则二者的体积之比为1:2,据此分析解答.
解答 解:由图可知,A→B(1 mL)、C→D(2 mL)分别是溶解Al(OH)3和使AlO2-恰好完全生成Al(OH)3沉淀消耗的NaOH和HCl,得关系式NaOH~Al(OH)3~AlO2-~H+,根据关系式可以推出:c(NaOH):c(HCl)=2:1;
O-B(6mL)是镁离子、铝离子和NaOH反应过程,该溶液中加入的体积为NaOH体积;9-21mL为偏铝酸根离子、氢氧化镁、氢氧化铝和HCl的反应,为HCl体积;
B-C体积为NaOH、HCl混合体积,因为c(NaOH):c(HCl)=2:1,则二者的体积之比为1:2,则BC处NaOH体积=3mL×$\frac{1}{3}$=1mL,所以NaOH总体积=6mL+1mL=7mL,
故答案为:7.
点评 本题考查离子方程式有关计算,为高频考点,侧重考查学生图象分析判断及计算能力,明确各个阶段发生的反应及溶液中存在溶质成分是解本题关键,难点是正确判断BC段NaOH溶液体积,题目难度中等.


科目:高中化学 来源: 题型:解答题
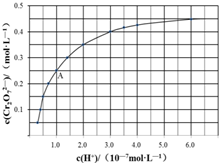 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
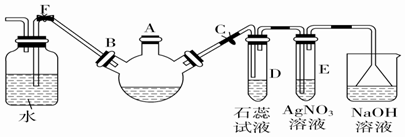
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0×10-7mol•L-1 | B. | 0.1×10-7mol•L-1 | C. | 5.0×10-6mol•L-1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
 ,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.
,含有的化学键类型离子键和共价键,Z2Y2为离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Cl-、CO32-、K+ | B. | Cu2+、Cl-、SO42-、OH- | ||
| C. | K+、Cl-、NO3-、H+ | D. | H +、Cl-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com