
| A. | 碳酸盐与盐酸之间的反应 | B. | 一切碳酸盐与一切酸之间的反应 | ||
| C. | 可溶性碳酸盐与强酸之间的反应 | D. | 可溶性碳酸盐与一切酸之间的反应 |
科目:高中化学 来源: 题型:实验题
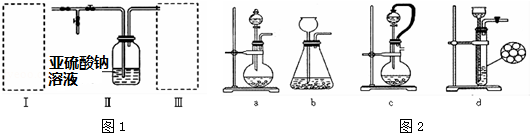
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐--①④ | B. | 碱--①⑥ | C. | 纯净物--③④⑤ | D. | 混合物--②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8gNa2O2含有的共价键数为0.2NA | |
| B. | 7.8gNa2S与Na2O2的混合物,含离子总数为0.3NA | |
| C. | 标准状况下,22.4L溴单质含有NA个溴分子 | |
| D. | 0.2 molNa被完全氧化生成7.8gNa2O2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灯光明暗程度不变 | B. | 灯光变暗 | ||
| C. | 灯光明暗程度变化不明显 | D. | 灯光变亮 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①反应的焓变为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ | B. | Ba2+ | C. | Cl- | D. | Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
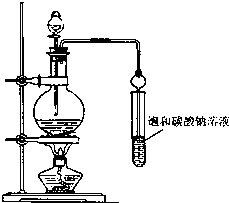 实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题:
实验室合成乙酸乙酯粗产品的步骤如下:在蒸馏烧瓶内将过量的乙醇和少量浓H2SO4混合,然后经分液漏斗边滴加醋酸,边加热蒸馏,直接收集蒸馏产品可得到含有乙醇、乙醚、醋酸、少量水的乙酸乙酯粗产品.据此回答问题: CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com