
【题目】联苄(![]() )是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
)是一种重要的有机合成中间体,实验室可用苯和1,2一二氯乙烷(ClCH2CH2Cl)为原料,在无水AlCl3催化下加热制得,其制取步骤为:
(一)催化剂的制备:下图是实验室制取少量无水AlCl3的相关实验装置的仪器和药品:

(1)将上述仪器连接成一套制备并保存无水AlCl3的装置,各管口标号连接顺序为:d接e,_______接_______,_________接________,_________接________。
(2)有人建议将上述装置中D去掉,其余装置和试剂不变,也能制备无水AlCl3。你认为这样做是否可行__________(填“可行”或“不可行”),你的理由是________________。
(3)装置A中隐藏着一种安全隐患,请提出一种改进方案:_____________。
(二)联苄的制备
联苄的制取原理为:![]()
反应最佳条件为n(苯) :n(1,2-二氯乙烷)=10 :1,反应温度在60-65℃之间。
实验室制取联苄的装置如下图所示(加热和加持仪器略去):
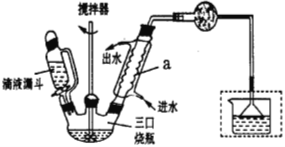
实验步骤:
在三口烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.7 mL1,2-二氯乙烷,控制反应温度在60-65℃,反应约60min。将反应后的混合物依次用稀盐酸、2%Na2CO3溶液和H2O洗涤分离,在所得产物中加入少量无水MgSO4固体,静止、过滤,先常压蒸馏,再减压蒸馏收集170~172℃的馏分,得联苄18.2 g。
相关物理常数和物理性质如下表
名称 | 相对分子质量 | 密度/(gcm-1) | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶水,可溶苯 |
无水氯化铝 | 133.5 | 2.44 | 178(升华) | 遇水水解,微溶苯 | |
联苄 | 182 | 0.98 | 52 | 284 | 难溶水,易溶苯 |
(4)仪器a的名称为______________,和普通分液漏斗相比,使用滴液漏斗的优点是_________。
(5)洗涤操作中,水洗的目的是_____________;无水硫酸镁的作用是______________。
(6)常压蒸馏时,最低控制温度是________________。
(7)该实验的产率约为______________。(小数点后保留两位有效数字)
【答案】(1)f,g,h,a,b,c
(2)不可行,制得的Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸。
(3)在硬质玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞。
(4)球形冷凝管;可以使液体顺利滴下。
(5)洗掉Na2CO3(或洗掉可溶性无机物);吸水剂(干燥剂)。
(6)83.5℃(7)72.85%
【解析】
试题分析:(1)验室制备无水氯化铁,需要先制取氯气,用2装置,根据题意3用于除去氯气中的氯化氢,4用于干燥氯气,由于无水氯化铁遇潮湿空气极易吸水生成FeCl3nH2O,所以5防止空气中的水蒸气进入,同时吸收未反应的氯气,防止污染空气,则仪器的连接顺序为d→e→f→g→h→a→b→c,故答案为:f;g;h;a;b;c;
(2)将上述装置中D去掉,其余装置和试剂不变,不能制备无水AlCl3,因为制得的Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸,故答案为:不可行;制得的Cl2中混有的HCl与Al反应生成H2,H2与Cl2混合加热时会发生爆炸;
(3)为了防止AlCl3冷凝成固体会造成试管堵塞,在硬质玻璃管与广口瓶之间用粗导管连接,故答案为:在硬质玻璃管与广口瓶之间用粗导管连接,防止AlCl3冷凝成固体造成堵塞;
(4)根据实验仪器的特点,知道该装置的名称是:球形冷凝管,和普通分液漏斗相比,使用滴液漏斗的优点是可以使液体顺利滴下,故答案为:球形冷凝管;可以使液体顺利滴下;
(5)洗涤操作中,第二次水洗主要是除去氯化铝、盐酸和碳酸钠(或洗掉可溶性无机物),洗涤后加入少量无水硫酸镁固体,目的是吸收产品中少量的水分,也可以用氯化钙代替,做吸水剂(干燥剂),故答案为:洗掉Na2CO3(或洗掉可溶性无机物);吸水剂(干燥剂);
(6)常压蒸馏时,减压蒸馏,可降低沸点,避免温度过高,导致副反应的发生,根据物质的熔沸点的高低,需要最低控制温度是83.5℃,故答案为:83.5℃;
(7)120mL苯(密度0.88g/mL)的物质的量为![]() mol=1.35mol,10.2mL1,2-二氯乙烷的物质的量为
mol=1.35mol,10.2mL1,2-二氯乙烷的物质的量为![]() mol=0.137mol,根据苯、1,2-二氯乙烷为原料制备联苯的方程式可知,苯过量,所以产品的理论产量为0.137mol×182g/mol=24.98g,产率=
mol=0.137mol,根据苯、1,2-二氯乙烷为原料制备联苯的方程式可知,苯过量,所以产品的理论产量为0.137mol×182g/mol=24.98g,产率=![]() ×100%=
×100%=![]() ×100%=72.85%,故答案为:72.85%。
×100%=72.85%,故答案为:72.85%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
![]()
(1)从三种不同分类标准回答,“铜绿”属于哪类物质? _。
(2)请写出铜绿与盐酸反应的化学方程式: 。
(3)写出B的化学式 。
(4)上述转化过程中属于化合反应的是 ,属于复分解反应的是 (填序号)。
(5)写出①反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0g投入盛有50mL0.1molL-1盐酸溶液的烧杯中,该铝片与盐酸反应,产生氢气的速率v(H2)与反应时间t的关系,可用如图所示的坐标曲线来表示,下列推论错误的是
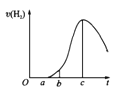
A.O→a段不产生氢气是因为表面的氧化物隔离了铝和稀盐酸
B.b→c段产生氢气的速率增加较快的主要原因之一是温度升高
C.t=c时刻,反应处于平衡
D.t>c时,产生氢气的速率降低的主要原因是溶液中H+浓度下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】内锌矿的主要成分为ZnS,含有杂质PbS、CuS、FeS、SiO2等,以闪锌矿制备氯化锌的流程如图所示。

请回答下列问题:
(1)配制氯化铁浸渍液时要求pH为0.8~1之间,pH太高则 ,pH太低,浸渍矿石会产生有害气体 ,操作①是 。由氯化锌溶液制备氯化锌晶体的方法是 。
(2)高沸点溶剂R—4E几乎不溶于水,120℃时硫在R—4E里的溶解度为365g,室温时溶解度为35.9g,从浸出液B提取硫的方法是 。硫是工业制备硫酸的原料,现有1吨矿石,硫的总含量为24%,最多制备浓度98%的硫酸 吨。
(3)氯化铁与硫化锌发生反应:![]() ,则氯化铁与FeS反应的方程式为 。
,则氯化铁与FeS反应的方程式为 。
(4)溶液X的成分的化学式为 ,该流程中循环使用的物质是 。
(5)由氯化亚铁溶液制备氯化铁溶液,可以用![]() 、
、![]() ,但生产成本高。酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为 。
,但生产成本高。酸性条件下,使用催化剂在50℃左右通入氧气转化的成本极低,反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D 同族,C+和B3-具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的原子个数为1:1的化合物,是人们生活的必需品。回答下列问题:
(1) 五种元素中,原子半径最大的是______,非金属性最强的是______(填元素符号)。
(2 )由A和D、E所形成的共价型化合物中,热稳定性差的是________(用化学式表示)。
(3) A和E形成的化合物与A和B形成的化合物反应,产物的化学式为________,
其中存在的化学键类型为________,用电子式表示A和B其形成化合物过程________。
(4) D最高价氧化物的水化物的化学式为____________。
(5) 单质C在充足的单质E中燃烧,反应的化学方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往200mL FeC13溶液中,通入0.672L标准状况下的H2S气体,气体完全被吸收,再加入过量的铁粉产生氢气,反应停止后,测得溶液中含有0.15 mol金属阳离子,求:
(1) FeC13溶液与H2S反应的离子方程式为__________________;
(2)加入过量铁粉充分反应后产生氢气在标准状况下的体积?
(3)原FeC13溶液的浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用金属活性的不同,可以采取不同的冶炼方法冶炼金属。下列反应所描述的冶炼方法不可能实现的是( )
A.2Al2O3(熔融) ![]() 4Al+3O2↑
4Al+3O2↑
B.Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
C.Fe+CuSO4 ===FeSO4+Cu
D.2NaCl(水溶液)![]() 2Na+Cl2↑
2Na+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
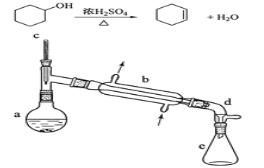
可能用到的有关数据如下:
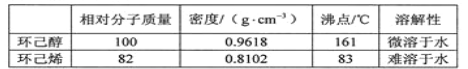
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10g。
回答下列问题:
(1)装置b的名称是 。
(2)加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 。
(4)分液漏斗在使用前须清洗干净并 ;在本实验分离过程中,产物应该从分液漏斗的 (填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是 。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有 (填正确答案标号)。
A.蒸馏烧瓶
B.温度计
C.吸滤瓶
D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是 (填正确答案标号)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁、铜合金加入到稀硝酸溶液中,两者恰好完全反应,假设反应过程中还原产物全部是NO,向所得溶液中加入物质的量浓度为3 mol·L-1的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1g,则下列有关叙述中正确的是( )
A. 开始加入合金的质量可能为3.6g
B. 参加反应的硝酸的物质的量为0.1mol
C. 沉淀完全时消耗NaOH溶液的体积为100mL
D. 溶解合金时产生NO的体积为2.24L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com