
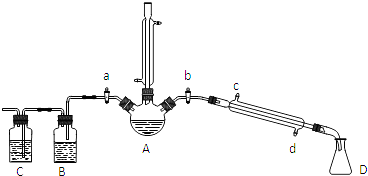
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
| 实际量 |
| 理论量 |
| △ |
| 9.6g |
| 13.7g |


科目:高中化学 来源: 题型:
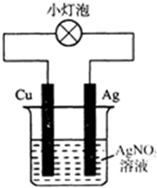
| A、该装置外电路中电流由Cu棒转移到Ag棒 |
| B、该装置中正极是Cu、负极是Ag |
| C、该装置是电解池 |
| D、该装置中正极上的电极反应为Ag++e-═Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
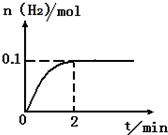 分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应:
分解水制氢气的工业制法之一是硫--碘循环,主要涉及下列反应: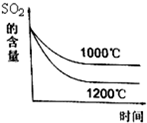 b、
b、
 d、
d、
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验要求 | 化学试剂 |
| 检验酒精中是否有水 | |
| 验证味精是否有食盐 | |
| 区别蔗糖和葡萄糖 | |
| 证明地瓜粉中含有淀粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、属于置换反应 |
| B、属于氧化反应 |
| C、Al作还原剂 |
| D、Fe2O3被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠着火时用水扑灭 |
| B、苯酚不慎沾到皮肤上,立即用酒精洗涤 |
| C、浓硫酸不慎沾到皮肤上,立即用大量水冲洗 |
| D、不慎接触过多的氨而使眼睛不适,立即用大量水冲洗眼睛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com