
【题目】将4g NaOH溶于水配成50mL溶液,取出5mL,这5mL溶液的物质的量浓度是( )
A. 2 mol/L B. 1 mol/L C. 0.1 mol/L D. 0.05 mol/L
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式: Zn(s)+ ![]() O2(g)═ZnO(s)△H=﹣351.1kJmol﹣1
O2(g)═ZnO(s)△H=﹣351.1kJmol﹣1
Hg(l)+ ![]() O2(g)═HgO(s)△H=﹣90.7kJmol﹣1
O2(g)═HgO(s)△H=﹣90.7kJmol﹣1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变△H为( )
A.﹣260.4 kJmol﹣1
B.﹣441.8 kJmol﹣1
C.+260.4 kJmol﹣1
D.+441.8 kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第一电离能I1是指气态原子X(g)失去一个电子成为气态阳离子X+(g)所需的能量.图是部分元素原子的第一电离能I1随原子序数变化的曲线图. 请回答以下问题: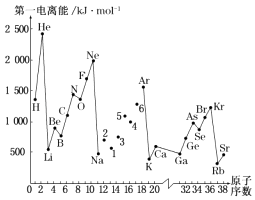
(1)从图分析可知,同一主族元素原子的第一电离能I1的变化规律是 .
(2)图中5号元素在周期表中的位置是、 .
(3)图中4、5、6三种元素的气态氢化物的沸点均比同主族上一周期的元素气态氢化物低很多,原因是: .
(4)气态锂原子失去核外不同电子所需的能量分别为:失去第一电子为519kJmol﹣1 , 失去第二个电子为7296kJmol﹣1 , 失去第三个电子为11 799kJmol﹣1 , 由此数据分析为何锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列行为不符合“绿色化学”这一主题的是( )
A. 推广和鼓励多使用公共交通工具出行
B. 秸秆就地焚烧,降低运输成本
C. 大力发展太阳能和风力发电
D. 对燃煤进行脱硫,减少SO2对空气的污染
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=1.2×10﹣11)、AgCl(Ksp=1.56×10﹣10)三种物质,下列说法正确的是( )
A.Mg(OH)2的溶解度最小
B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小
D.同一温度下Ksp越大的溶解度也越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A.能使pH试纸变红的溶液中:CO32﹣、K+、Cl﹣、Na+
B.![]() ═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
═10﹣10mol/L的溶液中:Na+、HCO3﹣、Cl﹣、K+
C.在c(OH﹣)/c(H+)=1×1012的溶液中:NH4+、Fe2+、Cl﹣、NO3﹣
D.由水电离产生的c(OH﹣)=1×10﹣12mol/L的溶液中:NO3﹣、Mg2+、Na+、SO42
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液 体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )
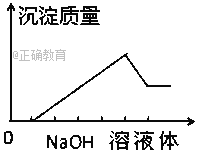
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
【答案】B
【解析】根据图像,可以看出分为4个阶段:第一阶段无沉淀,第二阶段沉淀量逐渐增多到最大量,第三阶段有部分沉淀能和氢氧化钠继续反应,即部分沉淀溶解,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加。第一阶段无沉淀,说明水溶液中一定含有氢离子,故AD错误,第三阶段有部分沉淀能和氢氧化钠继续反应,说明部分沉淀是氢氧化铝,原溶液中一定含有铝离子,第四阶段沉淀的量不再随着氢氧化钠量的增多而增加,说明一定有一种沉淀和氢氧化钠不反应,可推知该沉淀是氢氧化镁,原溶液中一定含有镁离子,铜离子有颜色,与溶液无色不符,故B正确,C错误;故选B。
【题型】单选题
【结束】
14
【题目】将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是( )
A. 2∶3 B. 3∶2
C. 1∶2 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾)。可用下列装置制备。

(1)装置B中盛放____溶液,C和F中装的是同一种试剂,该试剂为________________。
(2)装置A的圆底烧瓶中发生反应的化学方程式为_______________________________。
(3)实验步骤:如图连接装置后,先检验装置气密性,再装药品,然后点燃___________(填“A”或“C”)处酒精灯,当____(填实验现象)时,再点燃___________(填“A”或“C”)处酒精灯。
(4)装置G的作用是__________________,写出G中反应的离子方程式_____________________。
(5)甲同学认为装置D和E中间的细玻璃导管换成粗的玻璃导管为什么?___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】银耳本身为淡黄色,某地生产的一种“雪耳”,颜色洁白如雪.制作如下:将银耳堆放在密闭状态良好的塑料棚内,棚的一端支口小锅,锅内放有硫磺,加热使硫磺熔化并燃烧,两天左右,“雪耳”就制成了.“雪耳”炖而不烂,对人体有害,制作“雪耳”利用的是( )
A.硫的还原性
B.硫的漂白性
C.二氧化硫的还原性
D.二氧化硫的漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com