
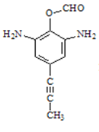
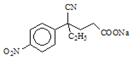
【题目】某研究小组按下列路线合成药物氨鲁米特。

①A到B为取代反应,B的化学式为C10H8N2O4,B到C是乙基化反应。
②C到D的反应包括水解、脱去羧基(CO2 )两步反应。
③
请回答:
(1)化合物A的结构简式________。
(2)下列说法不正确的是________。
A.化合物B能发生加成反应 B.化合物C能发生消去反应 C.化合物G具有碱性且在酸性条件下能水解生成CO2 D.氨鲁米特的分子式是C13H16N2O2
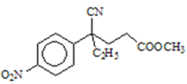
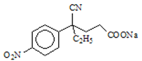
(3)设计化合物A转变为 的合成路线(用流程图表示,试剂任选)________。
的合成路线(用流程图表示,试剂任选)________。
(4)写出E→F的化学方程式________。
(5)写出化合物D可能的同分异构体的结构简式________,须同时符合:①1H-NMR谱表明分子中有4种氢原子,IR谱显示仅有苯环无其他环状结构,含氨基-NH2;②该物质能水解,且能发生银镜反应。
【答案】![]() BC
BC 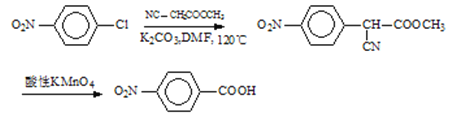
 +NaOH
+NaOH![]()
 +CH3OH
+CH3OH 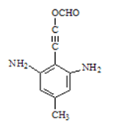

【解析】
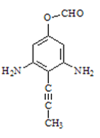
A到B为取代反应,B的化学式为C10H8N2O4,结合氨鲁米特结构简式可知A的结构简式为![]() ,B的结构简式为
,B的结构简式为![]() ,B到C是乙基化反应得到C,C的结构简式为
,B到C是乙基化反应得到C,C的结构简式为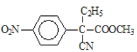 ,C到D的反应包括水解、脱去羧基(CO2)两步反应,则D的结构简式为
,C到D的反应包括水解、脱去羧基(CO2)两步反应,则D的结构简式为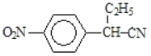 ,D与CH2=CHCOOCH3发生加成反应生成E,E的结构简式为
,D与CH2=CHCOOCH3发生加成反应生成E,E的结构简式为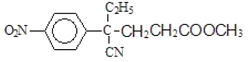 ,E发生水解反应生成钠盐F,F的结构简式为
,E发生水解反应生成钠盐F,F的结构简式为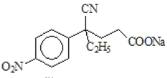 ,F经盐酸酸化生成
,F经盐酸酸化生成 ,
,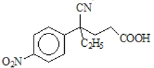 在硫酸和toluene条件下分子内发生反应生成G:
在硫酸和toluene条件下分子内发生反应生成G: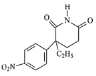 ,G催化加氢得到氨鲁米特;
,G催化加氢得到氨鲁米特;
(3)仿照氨鲁米特合成路线中A→B流程,利用取代反应将![]() 转化为
转化为![]() ,再利用酸性高锰酸钾溶液的强氧化性转化为对硝基苯甲酸钾,加酸酸化得到对硝基苯甲酸,据此分析解答。
,再利用酸性高锰酸钾溶液的强氧化性转化为对硝基苯甲酸钾,加酸酸化得到对硝基苯甲酸,据此分析解答。
(1)结合产物氨鲁米特的结构简式可知A的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)A.化合物B含有苯环,能与氢气发生加成反应,故A正确;
B.根据化合物C的结构简式可知,B
C.根据化合物G的结构简式可知,G含有亚氨基,具有碱性,在酸性条件下水解生成两个羧基COOH,不能生成CO2,故C错误;
D.根据氨鲁米特的结构简式可知,氨鲁米特的分子式是C13H16N2O2,故D正确;
故答案为:BC;
(3)仿照流程将A转化为B,加入酸性高锰酸钾溶液将其转化为对硝基苯甲酸钾,加酸酸化得到对硝基苯甲酸,合成路线为: ,
,
故答案为: ;
;
(4)E→F的反应是酯基发生完全水解反应生成钠盐和甲醇过程,方程式为 +NaOH
+NaOH![]()
 +CH3OH,
+CH3OH,
故答案为: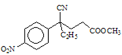 +NaOH
+NaOH![]()
![]() +CH3OH;
+CH3OH;
(5)化合物D可能的同分异构体中含有2个氨基NH2,含有酯基COO、并且能发生银镜反应,则化合物D的同分异构体甲酸酯类,并且分子中有4种氢原子,仅有苯环无其他环状结构,结合C四键规律形成可能的同分异构体为


 ,
,
故答案为:


 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室利用反应TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4装置如图所示:
TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4装置如图所示:

有关物质的性质如下表

下列说法正确的是( )
A.A和E分别盛装碱石灰和氢氧化钠溶液
B.点燃C处酒精灯后再往A中通入N2
C.A装置的名称是冷凝管
D.分离D中的液态混合物,所采用操作的名称是分馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是A、B、C.D、E、F等几种常见有机物之间的转化关系图,其中A是面粉的主要成分;C和E反应能生成F,F具有香味,B与E的实验式相同。
![]()
根据以上信息及各物质的转化关系完成下列各题:
(1)B的化学式为____________, C中所含官能团名称__________, 与B同分异构体的一种物质的名称_____________。
(2)其中能与新制氢氧化铜悬浊液在加热煮沸条件下能产生砖红色的沉定的物质有_______(填名称)
(3)写出C→D的化学方程式___________________________________________
(4)写出C+E→F的化学方程式_________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X原子结构示意图为________。
(2)元素Y的最高价氧化物的结构式为__________,其中一种同位素可测定文物年代,这种同位素的符号是________。
(3)元素Z能与氢元素形成-1价阴离子为_________,该阴离子的电子总数是________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为___________。
(5)ZW3常温下呈液态,可与水反应生成一种具有漂白性的酸和一种碱性气体,反应的化学方程式为_______。
(6)探寻物质的性质差异性是学习的重要方法之一。X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是_______(用酸的分子式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用钛铁矿(主要含FeTiO3及Fe2O3、SiO2等不溶性杂质)提取高品位TiO2的一种流程如下图所示。
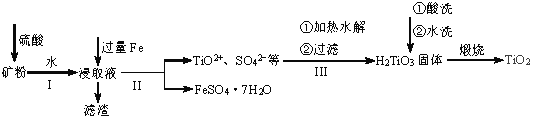
回答下列问题:
(1)有关钛的说法正确的是_________(填字母序号)。
A.TiOSO4中钛元素的化合价为+4价 |
B.TiO2中既含有离子键,又含有共价键 |
C.钛元素位于元素周期表中IVA族 |
D.在稀有气体氩氛围和800℃条件下,用金属镁与四氯化钛反应可制取金属钛。 |
反应的化学方程式为![]()
(2)为了从浸取液中获取纯净的FeSO4·7H2O,II中应采取的操作是_________、_________、过滤、洗涤、干燥。如何检验提取FeSO4·7H2O的溶液中存在Fe2+_________。
(3)III中生成H2TiO3的离子方程式是__________________。
(4)将TiO2与焦炭混合,通入氯气在1173K下反应,然后将生成的TiCl4与CO分离可制取TiCl4。 此反应中,氧化剂与还原剂物质的量之比是___________。TiCl4极易水解,利用此性质又可制备纳米级二氧化钛TiO2·XH2O,该反应的化学方程式是__________________。
(5)将TiO2熔于NaF 制成熔融盐,以石墨为阴极、覆盖了氧渗透膜的多孔金属陶瓷涂层为阳极,用如图所示电解装置制取金属钛。阳极电极反应式是__________________
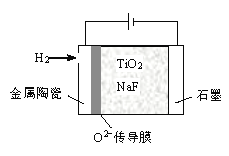
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有
是接触法生产硫酸的催化剂,属于两性氧化物,可从富钒炉渣(主要含有![]() 、
、![]() 和少量
和少量![]() 、
、![]() )中提取,其工艺流程如下:
)中提取,其工艺流程如下:

已知:①![]()
②一些金属阳离子沉淀的pH范围:
开始沉淀pH | 完全沉淀pH | |
| 6.5 | 9.0 |
| 2.2 | 3.5 |
| 4.1 | 5.4 |
(1)“酸浸还原”时![]() 转化为
转化为![]() ,写出有关
,写出有关![]() 反应的离子方程式________;经“氧化”后钒以
反应的离子方程式________;经“氧化”后钒以![]() 存在,写出生成
存在,写出生成![]() 反应的离子方程式________。
反应的离子方程式________。
(2)调节溶液![]() 至2.0~3.5,宜选用的试剂是________(填标号)。/span>
至2.0~3.5,宜选用的试剂是________(填标号)。/span>
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
(3)“滤渣1”的主要成分是________;![]() 粗品中的杂质为________。
粗品中的杂质为________。
(4)“沉钒”时需加入稀![]() ,其目的是________。
,其目的是________。
(5)焙烧产生的气体用________吸收后,其产物可以在该工艺中循环利用。
(6)![]() 在一定条件下可转化为不同价态的钒离子(
在一定条件下可转化为不同价态的钒离子(![]() 、
、![]() 、
、![]() 、
、![]() ),可作为全钒液充电流电池的电极液,电池总反应为
),可作为全钒液充电流电池的电极液,电池总反应为![]() 。下图是钒电池基本工作原理示意图:
。下图是钒电池基本工作原理示意图:
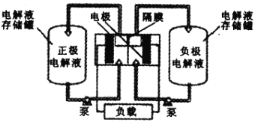
充电时阳极的反应式为____;能够通过钒电池基本工作原理示意图中“隔膜”的离子是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是磷酸、亚磷酸、次磷酸的结构式,其中磷酸为三元中强酸,亚磷酸为二元弱酸,则下列说法正确的是( )。
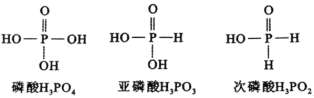
A.磷酸(![]() )的电离方程式为:
)的电离方程式为:![]()
B.亚磷酸(![]() )与足量NaOH溶液反应生成
)与足量NaOH溶液反应生成![]()
C.![]() 溶液呈酸性,是因为
溶液呈酸性,是因为![]() 的水解程度比电离程度大
的水解程度比电离程度大
D.![]() 溶液呈碱性
溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组用50ml 0.50mol/L NaOH溶液和30ml 0.50mol/L硫酸溶液进行中和热的测定实验。
(1)实验中大约要使用230mL NaOH溶液,配制溶液时至少需要称量NaOH固体__ g。
(2)做中和热的测定实验时:桌上备有大、小两个烧杯、泡沫塑料、硬纸板、胶头滴管、环形玻璃搅拌棒.实验尚缺少的玻璃仪器(用品)是______、______。
(3)他们记录的实验数据如下:
①请填写表中的空白:
实验次数 | 起始温度t1 | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | |
H2SO4 | NaOH | |||
1 | 25.0℃ | 25.0℃ | 29.1 | Δt=________ |
2 | 25.0℃ | 25.0℃ | 29.8 | |
3 | 25.0℃ | 25.0℃ | 28.9 | |
4 | 25.0℃ | 25.0℃ | 29.0 | |
②已知:溶液的比热容c为4.18 J·℃-1·g-1,溶液的密度均为1 g·cm-3。写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式____________(用该实验的数据,取小数点后一位)。
(4)若用氨水代替NaOH做实验,测定结果ΔH会___(填“偏大”、“偏大”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛合金在国防、医用器材领域有重要应用,某研究小组利用钛铁矿[主要成分偏钛酸亚铁(FeTiO3),含SiO2、FeO 杂质]制取TiCl4,然后进一步制备金属钛,流程如下∶

已知∶
a.发生的主要反应方程式如下∶
FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O TiOSO4+2H2O
TiOSO4+FeSO4+2H2O TiOSO4+2H2O![]() H2TiO3↓+H2SO4
H2TiO3↓+H2SO4
H2TiO3![]() TiO2+H2O
TiO2+H2O
b.部分物质的性质∶
TiCl4 | SiCl4 | FeCl3 | TiO2 | |
沸点/°C | 136.4 | 57.6 | 315 | / |
其它性质 | 极易水解 | / | / | 不溶于水 |
请回答∶
(1)步骤II抽滤时选用了玻璃砂漏斗,请说明选择的理由______。
(2)步骤III为了除去浸取液中的铁元素杂质并回收FeSO47H2O。往浸取液中加入铁粉至溶液中的Fe3+完全转化,然后抽滤,滤液用冰盐水快速冷却至FeSO47H2O结晶析出,再次抽滤并洗涤。下列说法正确的是____。
A.杂质Fe3+可能是在实验过程中氧化生成的
B.再次抽滤获得的滤液中的溶质是TiOSO4和FeSO4
C.利用冰盐水快速冷却有利于形成较大的晶体颗粒
D.再次抽滤后的洗涤应选用蒸馏水进行多次洗涤
(3)步骤IV包括钛盐的水解、产物的分离和物质的转化。操作步骤如下∶取一部分步骤III获得的滤液→(________)→(________)→(________)→(_________)→抽滤得偏钛酸(H2TiO3),将偏钛酸在坩埚中加热得到二氧化钛(TiO2)。
①将下列操作按合理顺序填入以上空格。
a.静置沉降后,用倾析法除去上层水;
b.逐滴加入到沸水中并不停搅拌,继续煮沸约10 min;
c.用热的稀硫酸洗涤沉淀2~3次,然后用热水洗涤沉淀;
d.慢慢加入其余全部滤液,继续煮沸约30 min (过程中适当补充水至原体积);
②写出操作c中用热水洗涤沉淀的具体过程_____。
(4)①另一种生产TiCl4的方法是用天然TiO2晶体为原料,利用步骤V的反应原理获得TiCl4.。产品中含有SiCl4、FeCl3等杂质,可通过精馏的方法获得高纯TiCl4,以下说法正确的是______。

A.收集TiCl4时,仪器a中的温度应控制为136.4°C
B. b处温度计的水银球的上沿和支管口的下沿齐平
C.精馏结束时留在圆底烧瓶中的主要成分是FeCl3和Si
D.装置c中的冷凝水应该“下口进、上口出”
E.可以用水浴加热的方法精馏获得TiCl4
②d处装有碱石灰的干燥管,作用是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com