
分析 (1)铝和铜与合适的电解质溶液构成原电池;
(2)铁为负极,铁离子的可溶性电解质溶液为电解质,负极发生氧化反应,正极发生还原反应书写电极反应式;
(3)该原电池中Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+、正极电极反应式为2H++2e-=H2↑,根据正负极反应式进行有关计算.
解答 解:(1)铜、铝的金属活泼性不同,遇到合适的电解质溶液易构成原电池,从而加快铝的腐蚀,所以不能把铜导线和铝导线连接在一起使用,
故答案为:形成原电池加速铝导线的腐蚀;
(2)根据反应可知Fe应为负极,被氧化,正极可为C、Cu等,电解质溶液含有Fe3+,乐为氯化铁或硫酸铁等,装置图为 ,
,
电极反应式为:负极(铁 )Fe-2e-═Fe2+,正极( 石墨)2Fe3++2e-═2Fe2+,故答案为: ;(铁 )Fe-2e-═Fe2+,( 石墨)2Fe3++2e-═2Fe2+;
;(铁 )Fe-2e-═Fe2+,( 石墨)2Fe3++2e-═2Fe2+;
(3)原电池中阴离子向负极移动,该原电池中Zn易失电子作负极、Cu作正极,负极上电极反应式为Zn-2e-=Zn2+、正极电极反应式为2H++2e-=H2↑,得失电子相同时,将正负极电极反应式相加得电池反应式为Zn+2H+=Zn2++H2↑,当有1mol电子通过时,负极上溶解m(Zn)=$\frac{1mol}{2}$×65g/mol=32.5g,正极上析出n(H2)=$\frac{1mol}{2}$=0.5 mol,故答案为:负;32.5;0.5.
点评 本题考查了原电池原理,知道正负极的判断方法及正负极上发生的反应即可解答,注意:只有得失电子相同时正负极电极反应式相加才能得到电池反应式,否则得不到电池反应式.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 还原性:Cl->Br->I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

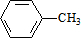 ,C的名称:苯甲醇
,C的名称:苯甲醇 +Cl2 $\stackrel{光照}{→}$
+Cl2 $\stackrel{光照}{→}$  +HCl,取代反应
+HCl,取代反应 ,取代反应
,取代反应  .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol阿司匹林( )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol )与足量的NaOH溶液反应,消耗NaOH最大的物质的量为2mol | |
| B. | 汽油、柴油等矿物油与植物油主要成分都是烃,均可以萃取溴水中的溴 | |
| C. | 丙氨酸和苯丙氨酸脱水,最多可生成4种二肽 | |
| D. | 苯酚能与溴水反应,苯不能与溴水反应,说明苯环对羟基有影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 放热反应一定比吸热反应的反应速率快 | |
| C. | 由焓判据和熵判据组合而成的复合判据,将更适合于所有的反应过程 | |
| D. | 反应速率快的反应,其反应物的转化率一定高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )$\stackrel{一定条件}{→}$PMAA
)$\stackrel{一定条件}{→}$PMAA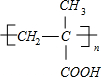 .
. $→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O
$→_{△}^{浓硫酸}$CH2=C(CH3)-COOH+H2O .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在正极上发生还原反应 | B. | 化学性质较活泼的金属为正极 | ||
| C. | 在外电路,电子流出正极 | D. | 是由电能转化为化学能的装置 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com