
【题目】(一)是元素周期表的一部分,表中所列的字母分别代表一种化学元素。
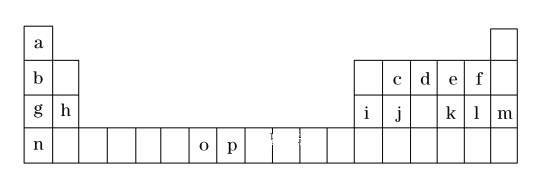
试回答下列问题:
①表中碱性最强的为_______(写出化学式);氢化物稳定性最强的为 ______ ;(写出化学式)
②基态o原子的价电子排布图为______;P3+离子与KSCN反应新生成的化学键为 _____ 键。
③将周期表中g、h、i、j四种元素的第一电离能由大到小排序为_________ (用元素符号表示)。
(二)SiO2晶胞(如图1)可理解成将金刚石晶胞(如图2)中的C原子置换成Si原子,然后在Si—Si之间插入O原子而形成。
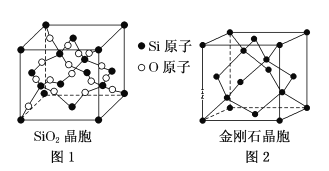
①推测SiO2晶胞中Si采用______杂化,O—Si—O的键角为___________。
②一个SiO2晶胞中,含有_______个Si原子。
③金刚石和晶体硅都是原子晶体,具有相似的结构,则熔点:金刚石_______Si晶体(填“大于”,“等于”或“小于”)
④假设金刚石晶胞的边长为a pm,NA为阿伏伽德罗常数,试计算该晶胞的密度______ g·cm-3(写出表达式即可)。
【答案】KOH HF ![]() 配位键 Si>Mg>Al>Na sp3 109°28′ 8 大于
配位键 Si>Mg>Al>Na sp3 109°28′ 8 大于 ![]()
【解析】
(一)根据元素在周期表中的位置知,a到p分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;结合原子结构与性质分析解答;
(二)①SiO2晶胞中Si原子形成4个Si-O键,没有孤电子对,杂化轨道数目为4,形成S-O正四面体结构,据此分析解答;
②SiO2晶胞中,4个Si处于晶胞内部,另外原子处于晶胞顶点、面心,根据均摊法计算晶胞中Si原子数目;
③金刚石和晶体硅都是原子晶体,碳原子半径小于硅原子半径,则C-C共价键的键能大于Si-Si共价键的键能,据此分析判断;
④根据均摊法,计算一个金刚石晶胞中含有碳原子数,进而计算晶胞的质量和晶胞的体积,最后计算晶胞的密度。
(一)根据元素在周期表中的位置知,a到p分别是H、Li、C、N、O、F、Na、Mg、Al、Si、S、Cl、Ar、K、Mn、Fe元素;
①元素的金属性越强,最高价氧化物的水化物的碱性越强,碱性最强的是KOH;元素的非金属性越强,氢化物越稳定,稳定性最强的为HF,故答案为:KOH;HF;
②基态Mn原子的外围电子为其3d、4s电子,其外围电子排布图为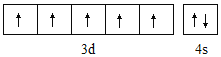 ,Fe3+离子与KSCN反应新生成的化学键为配位键,故答案为:
,Fe3+离子与KSCN反应新生成的化学键为配位键,故答案为: ;配位键;
;配位键;
③同一周期元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能Si>Mg>Al>Na,故答案为:Si>Mg>Al>Na;
(二)①SiO2晶胞中Si原子形成4个Si-O键,没有孤电子对,杂化轨道数目为4,Si原子采取sp3杂化,形成S-O正四面体结构,O-Si-O的键角为:109°28′,故答案为:sp3;109°28′;
②SiO2晶胞中,4个Si处于晶胞内部,另外原子处于晶胞顶点、面心,晶胞中Si原子数目=4+8×![]() +6×
+6×![]() =8,由化学式可知晶胞中O原子数目=8×2=16,故答案为:8;
=8,由化学式可知晶胞中O原子数目=8×2=16,故答案为:8;
③金刚石和晶体硅都是原子晶体,具有相似的结构,由于碳原子半径小于硅原子半径,则C-C共价键的键能大于Si-Si共价键的键能,因此熔点:金刚石>Si晶体,故答案为:大于;
④根据图示,一个金刚石晶胞中含有碳原子数=4+8×![]() 6×
6×![]() =8,则晶胞的质量=
=8,则晶胞的质量=![]() g,晶胞的体积为pm3=(a ×10-10)cm3,因此晶胞的密度=
g,晶胞的体积为pm3=(a ×10-10)cm3,因此晶胞的密度= =
=![]() g·cm-3,故答案为:
g·cm-3,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】苯甲酸钠(NaA)可作饮料的防腐剂,研究表明苯甲酸(HA)的抑菌能力显著高于A-,在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2。已知25 ℃时,HA、H2CO3的电离平衡常数分别为K=6.25×10-5、 K1=4.3×10-7,则下列说法正确的是(不考虑饮料中其他成分)
A. 提高CO2充气压力,饮料中c(A-)不变
B. 当pH为5.0时,饮料中![]() =0.16
=0.16
C. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
D. 结合H+的能力:A->HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体进行下列反应:3X+Y ![]() 2Z,在三种不同情况下测得的速率值为:
2Z,在三种不同情况下测得的速率值为:
① v(X)=1 mol·L-1·s-1; ② v(Y)=0.5 mol·L-1·s-1; ③ v(Z)=0.5 mol·L-1·s-1。
这三种情况下反应的速率大小情况为
A. ③>②>① B. ②>①>③ C. ①>②>③ D. ③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成![]() 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答
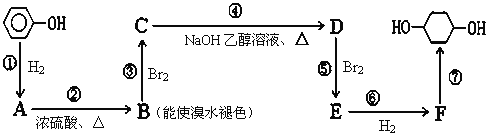
(1)写出鉴别苯酚与A这2种有机物的方法,用必要的文字说明: .
(2)写出以下物质的结构简式:B ,F .
(3)写出反应④的化学反应方程式:④ ,
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,下列物质不能与二氧化硅反应的是( )
①焦炭 ②纯碱 ③碳酸钙 ④氢氟酸 ⑤高氯酸 ⑥氢氧化钾 ⑦氧化钙⑧ 氮气
A.③⑤⑦⑧B.⑤⑦⑧C.⑤⑧D.⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是以石油为原料制备某些化工产品的部分流程。请回答:
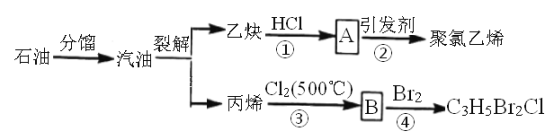
(1)写出反应②的化学方程式________________。
(2)B分子中无甲基,则B的结构简式为___________________。
(3)反应①和③的类型依次是______________、______________。
(4)写出反应④化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图像的说法中正确的是
A. 图① 表示可逆反应“CO(g)+H2O(g)
表示可逆反应“CO(g)+H2O(g)![]() CO2(g)+H2(g)”中的ΔH大于0
CO2(g)+H2(g)”中的ΔH大于0
B. 图②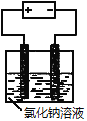 以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
以石墨为电极电解氯化钠稀溶液的电解池中,阴、阳极产生气体体积之比一定为1∶1
C. 图③ 表示碳酸钠溶液加水稀释时溶液的pH值变化
表示碳酸钠溶液加水稀释时溶液的pH值变化
D. 图④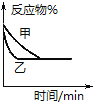 表示压强对可逆反应2A(g)+2B(g)
表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是

(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A. 在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邻苯二甲酸(用H2A表示)为二元弱酸,常温下,Ka1=1.1×10-3,Ka2=3.9×10-6,室温下用0.100 0 mol·L-1 NaOH溶液滴定20.00 mL 0.100 0 mol·L-1 H2A溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是
A.滴加20 mL NaOH溶液时:c(OH-)>c(H+)+c(H2A )-2c(A2-)
B.pH=7的溶液:c(Na+)<0.050 00 mol·L-1+c(A2-) -c(H2A)
C.滴定过程中可能会出现:c(Na+)>c(HA-)=c(A2-)>c(OH-)>c(H+)
D.滴加40 mL NaOH溶液时:2c(Na+)=c(H2A)+c(A2-)+c(HA-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com