
【题目】有科学家正在研究用碳与一氧化氮反应处理环境问题
C(s)+2NO(g)![]() CO2(g)+N2(g)△H
CO2(g)+N2(g)△H
(1)实验方案中有下列措施:①采用加热提高反应速率,②使用催化剂提高反应速率,③使用加压提高NO转化率,④使CO2转化成干冰从体系用脱离,提高NO的转化率,你认为可行的是_________。
(2)这个反应的平衡常数表达式是_________________;
(3)在恒容恒温密闭容器中,科学家得到下列实验数据
时间(min) | 浓度(mol/L) | ||
NO | N2 | CO2 | |
0 | 0.100 | 0 | 0 |
10 | 0.058 | 0.021 | 0.021 |
20 | 0.040 | 0.030 | 0.030 |
30 | 0.040 | 0.030 | 0.030 |
反应在该温度下的平衡常数K=_________________;
(4)若在(3)的实验中30min时开始升温,36min时达平衡,测得NO的转化率变为50%,则该反应的△H_______0(填“>”、“<”、“=”),判断的理由是___________________;
(5)若科学家在30min后改变了某一条件,反应进行到40min时达平衡浓度分别为c(NO)=0.032mol/L,c(N2)=0.034mol/L,c(CO2)=0.017mol/L,则改变的条件可能是______,判断的依据是____________________。
【答案】①②④![]()
![]() <升温后NO的转化率减小,说明升温平衡逆向移动,正反应放热分离出部分CO2因为降温时反应正向移动,生成物浓度都增大,加压平衡不移动,各组分浓度都增大,只能是分离出部分二氧化碳,平衡正向移动,才会导致c(NO)和c(CO2)减小,c(N2)增大
<升温后NO的转化率减小,说明升温平衡逆向移动,正反应放热分离出部分CO2因为降温时反应正向移动,生成物浓度都增大,加压平衡不移动,各组分浓度都增大,只能是分离出部分二氧化碳,平衡正向移动,才会导致c(NO)和c(CO2)减小,c(N2)增大
【解析】
(1)①升温正逆反应速率都增大,故采用加热提高反应速率可行;②催化剂能够加快反应速率,使用催化剂提高反应速率可行;③该反应前后气体体积相等,加压平衡不移动,使用加压提高NO转化率不可行;④分离出生成物平衡正向移动,使CO2转化成干冰从体系用脱离,提高NO的转化率可行;故答案为:①②④;
(2)C(s)+2NO(g)![]() CO2(g)+N2(g)△H,化学平衡常数K=
CO2(g)+N2(g)△H,化学平衡常数K=![]() ═
═![]() ,故答案为:K=
,故答案为:K=![]() ;
;
(3)根据表格数据可知,20s后反应达到平衡状态,K=![]() =
=![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;
(4)原平衡中NO的转化率为![]() ×100%=60%,升温后NO的转化率变为50%,说明升温平衡逆向移动,正反应放热,△H<0,故答案为:<;升温后NO的转化率减小,说明升温平衡逆向移动,正反应放热;
×100%=60%,升温后NO的转化率变为50%,说明升温平衡逆向移动,正反应放热,△H<0,故答案为:<;升温后NO的转化率减小,说明升温平衡逆向移动,正反应放热;
(5)改变了某一条件,达到新的平衡时,c(NO)和c(CO2)减小,c(N2)增大,只能是分离出部分二氧化碳,因为降温时反应正向移动,生成物浓度都增大,加压平衡不移动,各组分浓度都增大,只能是分离出部分二氧化碳,平衡正向移动,才会导致c(NO)和c(CO2)减小,c(N2)增大,故答案为:分离出部分二氧化碳;因为降温时反应正向移动,生成物浓度都增大,加压平衡不移动,各组分浓度都增大,只能是分离出部分二氧化碳,平衡正向移动,才会导致c(NO)和c(CO2)减小,c(N2)增大。


科目:高中化学 来源: 题型:
【题目】某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO2-、CO32-、SiO32-、Cl-中的几种,现进行如下实验:
①取少量溶液,逐滴加入氢氧化钠溶液过程中无沉淀生成;
②另取少量原溶液,逐滴加入5mL 0.2mol·L-1的盐酸,产生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失;
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到沉淀0.43 g;
下列说法中正确的是
A. 该溶液中可能含有Cl-
B. 该溶液中一定含有K+、AlO2-、CO32-、Cl-
C. 步骤②中产生的白色沉淀为硅酸
D. 该溶液是否有K+需做焰色反应实验 (透过蓝色钴玻璃片)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷燃料电池的工作原理示意图如下,下列说法中正确的是

A. a 为负极,电极反应式为 CH3CH3-14e-+18OH-===2CO32-+12H2O
B. 电子从 a 极经导线移向 b 极,再经溶液移向 a 极
C. 电池工作一段时间后电解质溶液的 pH 增大
D. 用该电池电解硫酸铜溶液(电解池的电极为惰性电极),消耗氧气的物质的量与析出铜的物质的量之比为 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。将CO2转化为甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)。
(1)在一恒温恒容密闭容器中充入1 mol CO2和3 mol H2进行上述反应。测得CO2(g)和CH3OH(g)浓度随时间变化如图所示。

①0~10 min内,氢气的平均反应速率为____________,第10 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡________(填“正向”“逆向”或“不”)移动。
②若已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH=-a kJ·mol-1;
2H2(g)+O2(g)===2H2O(g) ΔH=-b kJ·mol-1;
H2O(g)===H2O(l) ΔH=-c kJ·mol-1;
CH3OH(g)===CH3OH(l) ΔH=-d kJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)如图,25 ℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解600 mL一定浓度的NaCl溶液,电池的正极反应式为_________________________________。

在电解一段时间后,NaCl溶液的 pH 变为12(假设电解前后NaCl溶液的体积不变),则理论上消耗甲醇的物质的量为________mol。
(3)向(2)U形管内电解后的溶液(假设NaCl溶液完全被电解)中通入标准状况下89.6 mL 的CO2气体,则所得溶液呈________(填“酸”“碱”或“中”)性,溶液中各离子浓度由大到小的顺序为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )

A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了检验淀粉的水解产物,某学生设计了如下实验方案:
![]()
请回答下列问题
(1)试剂1为20%的H2SO4溶液,其作用是___________________;
(2)试剂2为_____,其作用是____________;
(3)反应①的化学方程式为_______________________;
(4)为了检验淀粉是否已经完全水解,取少量水解液于试管中,加入碘水。则证明淀粉未完全水解的现象是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子式的运用
(1)用电子式表示粒子:
①氢氧根离子________;②羟基________;③二氧化碳分子_________。
(2)用电子式表示化合物的形成过程
④MgF2___________________________;⑤H2O _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时, c mol·L—1CH3COOH 溶液加水稀释, 溶液中 CH3COOH 和 CH3COOˉ二者中各自所占的物质的量分数(α)随溶液 pH 变化的关系如图所示。下列说法不正确的是
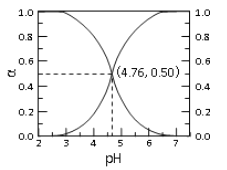
A. 由图可知, 25℃时醋酸的 Ka=10-4.76
B. c mol·L—1CH3COOH 溶液加水稀释中, α(CH3COOH)增大, c(CH3COOˉ)也一定增大
C. 在 pH=4.76 的溶液中通入 HCl, α(CH3COOH)增大,α(CH3COOˉ)减小, α(CH3COOH)+α(CH3COOˉ)=1
D. 对于图像中曲线上任意一点所对应的溶液中,都有 c(CH3COOˉ)+c(OHˉ)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com