
【题目】已知A、B、C、D、E是原子序数依次增大的五种短周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为6,D是同周期中简单离子半径最小的元素。
(1)五种元素中,E在元素周期表中的位置是______,画出C的原子结构示意图:________。
(2)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为_____。
(3)C的最高价氧化物对应的水化物与D的最高价氧化物反应的化学方程式为__________________。
(4)已知X、Y、Z三种物质中均含有上述元素中的某一种元素,它们之间存在如图所示的转化关系:
![]()
①X、Y、Z均含有同一种金属元素,若W固体俗称干冰,则反应Y→Z的离子方程式为______;若W是强碱,且Y是白色难溶固体,则反应Y →Z的离子方程式为__________________。
②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则反应Z→Y的离子方程式为_____________________。
【答案】第三周期ⅦA族![]() 离子键和共价键Al2O3+2NaOH=2NaAlO2+H2OCO32-+CO2+H2O===2HCO
离子键和共价键Al2O3+2NaOH=2NaAlO2+H2OCO32-+CO2+H2O===2HCO![]() Al(OH)3+OH-=AlO
Al(OH)3+OH-=AlO![]() +2H2O3Fe2++NO
+2H2O3Fe2++NO![]() +4H+===3Fe3++NO↑+2H2O
+4H+===3Fe3++NO↑+2H2O
【解析】
A、B、C、D、E是原子序数依次增大的五种短周期元素,E元素的最高正化合价与最低负化合价的代数和为6,又根据主族元素最高正化合价与最低负化合价绝对值之和等于8可得,E的最高价是+7价,根据最高正化合价等于主族序数,可得E是第ⅦA族元素,则E是Cl元素;A与B、A与E形成共价化合物,A与B形成化合物的水溶液呈碱性,则该化合物是氨气,因此A是H元素,B是N元素;D是同周期中离子半径最小的元素,原子序数大于N元素而小于Cl元素,D应该是第三周期的Al元素;C原子序数大于N元素,又因为A、C同主族,所以C是Na元素。
(1)E是Cl元素,原子序数是17,在周期表中的位置是第三周期第ⅦA族;C是Na元素,原子序数是11,其原子结构示意图为![]() 。
。
(2)B是N元素,N元素的气态氢化物NH3与其最高价氧化物对应的水化物HNO3反应生成的化合物是NH4NO3,硝酸铵中存在的化学键类型为:离子键和共价键。
(3)C是Na元素,D是Al元素,钠元素的最高价氧化物对应的水化物NaOH与铝元素的最高价氧化物Al2O3反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O。
(4)①X、Y、Z均含有同一种金属元素,若W固体俗称干冰,则W是CO2;根据转化关系图可知X是氢氧化钠、Y是碳酸钠、Z是碳酸氢钠,所以反应Y→Z的离子方程式为:CO32-+H2O+CO2=2HCO3-;若W是强碱,且Y为白色难溶固体,则W是氢氧化钠、Y是氢氧化铝,X是氯化铝、Z是偏铝酸钠,所以反应Y→Z的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O。②X、Y、Z是均含有同一种非金属元素的化合物,W是一种常见金属单质,且上述转化均在常温条件下完成,则W是Fe单质、X是硝酸、Y是硝酸铁、Z是硝酸亚铁,所以反应Z→Y的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O。


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是
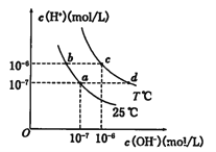
A. 向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-)
B. 25℃时,加入CH3COONa可能引起由c向d的变化,升温可能引起a向c的变化
C. T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
D. b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外, 曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_____。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液。
① [Ni(NH3)6]SO4中 H、N、O 元素的电负性由大到小的顺序为_____;SO42-的立体构型是_________;与 SO42-互为等电子体的微粒为_____(填化学式,任写一种)。
② 氨的沸点高于膦(PH3),原因是______; 氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 。
(3)元素铜与镍的第二电离能分别为:ICu=1959kJ/mol ,INi=1753kJ/mol ,第二电离 ICu>INi 的原因是____________。
(4)铜的某种氯化物不仅易溶于水,而且易溶于乙醇和丙酮,其链状结构如图所示,则该氯化物的 化学式为____________________,属于_____晶体。

(5)Cu2+与乙二胺可形成上右图所示配离子,其中所含化学键类型有 ____(填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键 e.金属键
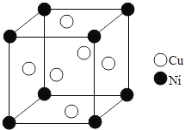
(6)某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 1 mol·L-1的NaHCO3 溶液中含有HCO3-的数目为NA
B. 78 g 苯含有C=C 双键的数目为3NA
C. 常温常压下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
D. 冰醋酸和葡萄糖的混合物30g含有碳原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol·L-1的盐酸滴定20.00 mL 0.10 mol·L-1的某碱BOH溶液得到的滴定曲线如图,下列判断不正确的是
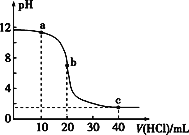
A. a点时,溶液呈碱性,溶液中c(B+)>c(Cl-)
B. b点时溶液的pH=7
C. 当c(Cl-)=c(B+)时,V(HCl)<20 mL
D. c点时溶液中c(H+)约为0.033 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图。已知:苯环上卤素不水解,下列有关说法不正确的是
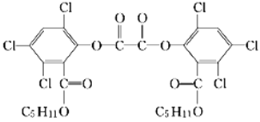
A. 草酸二酯的分子式为C26H24Cl6O8
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 1 mol草酸二酯与氢气完全反应,需要氢气6 mol
D. 1 mol草酸二酯与氢氧化钠稀溶液反应,最多消耗4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化属于吸热反应的是( )
①浓硫酸稀释 ②Ba(OH)2·8H2O与固体NH4Cl混合 ③ H2在O2中完全燃烧 ④Al与盐酸反应
A.①B.②C.③D.④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com