
| A. | Na2CO3和NaHCO3粉末与同浓度盐酸反应,Na2CO3碱性强,反应放出气体速度快 | |
| B. | 等物质的量的两种盐与同浓度的盐酸反应,Na2CO3消耗盐酸的体积是NaHCO3的两倍 | |
| C. | 向Na2CO3饱和溶液中通入过量CO2,有NaHCO3结晶析出 | |
| D. | Na2CO3和NaHCO3溶液分别和BaCl2溶液反应,现象不同 |
分析 NaHCO3不稳定,溶解度比Na2CO3小,与盐酸反应较Na2CO3剧烈,可与NaOH反应生成Na2CO3,Na2CO3可与水、二氧化碳反应生成NaHCO3,以此解答该题.
解答 解:A.分别滴加HCl溶液,反应离子方程式为CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑,相同条件下NaHCO3比Na2CO3反应放出气体剧烈,故A错误;
B.都与盐酸反应生成二氧化碳气体:Na2CO3+2HCl=2NaCl+H2O+CO2↑,NaHCO3+HCl=NaCl+H2O+CO2↑,由方程式可知Na2CO3消耗盐酸的体积是NaHCO3的两倍,故B正确;
C.Na2CO3比NaHCO3易溶于水,在饱和Na2CO3溶液中通入过量二氧化碳气体可得到NaHCO3沉淀,故C正确;
D.碳酸钠可与氯化钡反应生成碳酸钡沉淀,而碳酸氢钠不反应,故D正确.
故选A.
点评 本题考查Na2CO3和NaHCO3性质的异同,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度不大,注意把握Na2CO3和NaHCO3性质,注重基础知识的积累.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:实验题
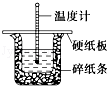 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1 NaOH溶液在图示的装置中进行中和反应,通过测定反应过程中的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取一定量固体,溶解,向溶液中滴加适量AgNO3溶液,观察到有白色沉淀生成,说明原固体中一定含有NaCl | |
| B. | 取一定量固体,溶解,向溶液中加入适量CaO粉末,充分反应后观察到有白色沉淀生成,说明原固体中一定含有Na2CO3 | |
| C. | 取一定量固体,溶解,向溶液中通入足量的CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3 | |
| D. | 称取3.80g固体,加热至恒重,质量减少了0.620g.用足量稀盐酸溶解残留固体,充分反应后,收集到0.880g气体,说明原固体中仅含有Na2CO3和NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
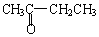
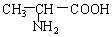 与
与
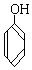 与
与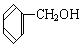
 与
与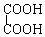
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 现象 | 结论 | |
| A | 先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 先滴加稀盐酸再滴加AgNO3溶液 | 生成白色沉淀 | 原溶液中有Cl- |
| C | 用洁净铁丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有K+ |
| D | 滴加NaOH溶液加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com