
【题目】(11分)铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作_____剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
__Cr2O72-+__SO32-+__ □=__Cr3++__SO42-+ __H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:
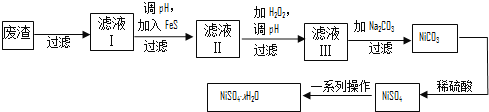
![]() ①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______________。
【答案】
(1)氧化;
(2)Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;
(3)4Na+TiCl4═Ti+4NaCl;
(4)①FeS+Cu2+=CuS+Fe2+;
②氧化Fe2+,除去Fe3+;
③增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4)。
【解析】
试题分析:(1)CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2中的Ce是+4价,在H2O2的作用下可生成Ce3+,因此发生还原反应,CeO2在该反应中作氧化剂;故答案为:氧化;
(2)自然界中Cr主要以+3价和+6价存在.+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬,根据得失电子相等,Cr2O72-与SO32-的物质的量之比是1:3;反应的离子方程式:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;故答案为:Cr2O72-+3SO32-+8H+=2Cr3++3SO42-+4H2O;
(3)工业上在550℃时用钠与四氯化钛反应可制得钛,四氯化钛被钠还原为钛,反应的化学方程式为:4Na+TiCl4═Ti+4NaCl;故答案为:4Na+TiCl4═Ti+4NaCl;
(4)①FeS除去Cu2+的反应是沉淀的转化,即FeS+Cu2+=CuS+Fe2+;故答案为:FeS+Cu2+=CuS+Fe2+;
②对滤液Ⅱ加H2O2的目的是将Fe2+氧化Fe3+,然后调pH沉淀Fe3+;故答案为:氧化Fe2+,除去Fe3+;
③NiSO4与Na2CO3反应生成NiCO3沉淀,而后过滤,再加适量稀硫酸溶解又生成NiSO4,这样可提高NiSO4的浓度,有利于蒸发结晶;故答案为:增大NiSO4的浓度,利于蒸发结晶(或富集NiSO4)。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】下列关于糖类、油脂、蛋白质的说法中正确的是
A.糖类都能发生水解反应
B.葡萄糖与果糖是同分异构体,淀粉与纤维素也是同分异构体
C.利用油脂在碱性条件下的水解,可以制甘油和肥皂
D.蛋白质溶液中,加入浓的硫酸铵溶液有沉淀析出,属于蛋白质的变性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )

A.工业生产中常选用NaOH作为沉淀剂
B.粗盐可采用溶解、过滤和重结晶等过程进一步提纯
C.向苦卤中通入Cl2是为了提取溴
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制备,其中a中加乙醇、乙酸和浓硫酸,在试管b中加入7mL饱和碳酸钠溶液。连接好装置。用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验。回答下列问题:

(1)a中配置混合溶液时,加入试剂的正确顺序是_______(填“A”或“B”);
A.先加入2mL浓硫酸,再慢慢注入2mL乙醇和3mL乙酸
B.先加入2mL乙醇,再慢慢注入2mL浓硫酸和3mL无水乙酸
(2)写出a试管中的主要化学反应的方程式:____________________________。
(3)加入浓H2SO4的目的是_____________________。
(4)在实验中球形干燥管除起冷凝作用外,另一个重要作用是_______。
(5)若要将b试管中的乙酸乙酯分离出来,应采用的实验操作是______________(填操作名称);
(6)将1mol 乙醇(其中的氧用 18O 标记)在浓硫酸存在条件下与足量乙酸充分反应。下列叙述不正确的是_______。
A.生成的乙酸乙酯中含有18O
B.生成的水分子中含有18O
C.可能生成 44g 乙酸乙酯
D.不可能生成 90g 乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)③⑤⑥⑦中原子半径最大的是 (用元素符号表示,下同),②③④⑤的简单离子中半径最小的是 。
(2) ③⑤中元素的金属性强弱顺序为 ,⑥⑦元素的非金属性强弱顺序为
(3)①、②两种元素按原子个数比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)碳酸钠溶液呈碱性的原因 。(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题。

(1)仪器a的名称为________;仪器b中可选择的试剂为________。
(2)实验室中,利用装置A,还可制取的无色气体是________(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管中有无色无味的气体产生,上述现象证明NH3具有________性,写出相应的化学方程_ 。
(4)装置E中浓硫酸的作用是_______________________。
(5)读取气体体积前,应对装置F进行的操作:_____________________。
(6)实验完毕,若测得干燥管D增重m g,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比值为________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含下列键型的物质,可能为单质的是( ).
A.只有离子键的物质
B.既有离子键,又有非极性键的物质
C.既有极性键,又有离子键的物质
D.只有非极性键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类正确的是( )
A.KNO3是钾盐、硝酸盐,也是正盐
B.漂白粉、明矾、铝热剂都是混合物
C.有机玻璃、氮化硅都是有机高分子材料
D.CO、CO2、SO2均为酸性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计)
A.0.225mol/L B.0.30mol/L C.0.36mol/L D.0.45mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com