
分析 反应②6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH中,Fe元素化合价由+2价变为+3价、N元素化合价由+3价变为-3价,得电子的物质是氧化剂,失电子的物质是还原剂,还原剂被氧化;整个过程中,铁由0价变+$\frac{8}{3}$价,所以1mol的铁转移$\frac{8}{3}$mol的电子,由此分析解答.
解答 解:该反应6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH中,Fe元素化合价由+2价变为+3价、N元素化合价由+3价变为-3价,得电子的物质是氧化剂,失电子的物质是还原剂,还原剂被氧化,所以该反应中氧化剂是 NaNO2,整个过程中,铁由0价变+$\frac{8}{3}$价,所以1mol的铁转移$\frac{8}{3}$mol的电子,n(Fe)=$\frac{168g}{56g/mol}$=3mol,所以整个过程中,转移电子的物质的量为:3mol×$\frac{8}{3}$=8mol; 故答案为:NaNO2;8.
点评 本题考查了氧化还原反应,根据元素化合价变化再结合基本概念来确定氧化剂、还原剂,再根据方程式中各个物理量之间的关系进行计算,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | HCO3-+CO32-+3H+→2CO2↑+2H2O | B. | HCO3-+3CO32-+7H+→4CO2↑+4H2O | ||
| C. | 2HCO3-+CO32-+4H+→3CO2↑+3H2O | D. | CO32-+H+→HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AtI与液氨反应,是非氧化还原反应 | |
| B. | AtI与液氨反应,AtI既是氧化剂又是还原剂 | |
| C. | ZnAt2只是氧化产物 | |
| D. | ZnI2是氧化产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
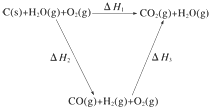 将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);
将煤转化为水煤气的主要化学反应为C(s)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .K在周期表的位置是第四周期ⅠA;25Mn属于ⅦB或副族族元素.
.K在周期表的位置是第四周期ⅠA;25Mn属于ⅦB或副族族元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2和N2O4组成的46g混合气体中氮原子的数目为NA | |
| B. | 1molC2H2分子中含有σ键的数目为2NA | |
| C. | HClO光照分解产生22.4LO2,转移的电子数为4NA | |
| D. | 常温下,1L0.1mol/LFe2(SO4)3溶液中阳离子数小于0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
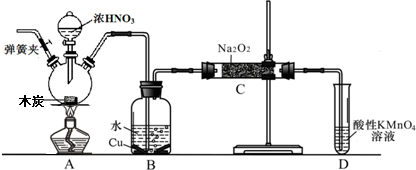
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | B. | 2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3 | ||
| C. | Fe+CuSO4═FeSO4+Cu | D. | 2NH4Cl+Ca(OH)2═CaCl2+2NH3↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com