
下列各溶液中,Na+浓度最大的是( )
A.4 L 0.5 mol·L-1的NaCl溶液 B.1 L 0.3 mol·L-1的Na2SO4溶液
C.0.8 L 0.4 mol·L-1的NaOH溶液 D.2 L 0.15 mol·L-1的Na3PO4溶液
科目:高中化学 来源: 题型:
常温下,下列离子浓度的关系正确的是 ( )
A.pH=2的盐酸与pH=12的氨水等体积混合:
c(NH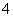 )=c(Cl-)>c(H+)=c(OH-)
)=c(Cl-)>c(H+)=c(OH-)
B.0.2 mol·L-1的CH3COONa溶液与0.1 mol·L-1的HCl等体积混合:
c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-)
C.0.1 mol·L-1的HCN(弱酸)和0.1 mol·L-1的NaCN等体积混合:
c(HCN)+c(CN-)+c(OH-)=c(Na+)+c(H+)
D.相同物质的量浓度时,溶液中c(NH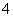 )由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3·H2O
)由大到小的顺序:NH4Al(SO4)2>NH4Cl>CH3COONH4>NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在体积为3 L的密闭容器中反应CO(g)+ 2H2(g) 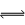 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
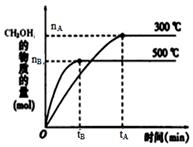 (1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(1)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用含图中字母的代数式表示)。
(2)判断该可逆反应达到化学平衡状态的标志是__________(填字母)。
a.v消耗(CH3OH)=2 v消耗(H2)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(3)300℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是__________(填字母)。
a.c(H2)减少
b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加
d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
①标准状况下,6.02×1023个分子所占的体积约是22.4 L
②0.5 mol H2所占体积为11.2 L
③标准状况下,1 mol H2O的体积为22.4 L
④标准状况下,28 g CO与N2的混合气体的体积约为22.4 L
⑤各种气体的气体摩尔体积都约为22.4 L·mol-1
⑥标准状况下,体积相同的气体的分子数相同
A.①③⑤ B.④⑥
C.②④⑥ D.①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
质量都是50 g的HCl、NH3、CO2、O2四种气体:
(1)含有分子数目最少的是________;
(2)同温同压下,体积最大的是________;密度最小的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 g NaOH固体溶于水配成250 mL溶液,此溶液中NaOH的物质的量浓度为__________。取出10 mL此溶液,这10 mL溶液中NaOH的物质的量浓度为___________,其中含有NaOH________g。将取出的溶液加水稀释到100 mL,稀释后的溶液中NaOH的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
要使相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中所含SO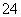 的数目相同,则所取两溶液的体积比是( )
的数目相同,则所取两溶液的体积比是( )
A.1∶3 B.3∶1
C.3∶2 D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
①有尘埃的空气、②溴水、③蒸馏水、④沸水中加几滴FeCl3浓溶液、⑤淀粉溶液,其中不存在丁达尔效应的分散系是( )
A.② B.②③⑤ C.②③ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子, 其氢化物水溶液呈碱性 |
| Z | 元素最高正化合价是+7价 |
(1)元素X的一种同位素可用于测定文物年代,这种同位素的符号是:________。
(2)元素Y与氢元素形成一种离子YH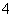 ,写出某溶液中含该微粒的检验方法:
,写出某溶液中含该微粒的检验方法:
________________________________________________________________________。
(3)元素Z与元素T相比,得电子能力较强的是________(用元素符号表示),下列表述中能证明这一事实的是________。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种的是________,理由是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com